difúzia a výpotok sú dva zákony, ktoré v 19. storočí navrhol škótsky chemik Thomas Graham na základe svojich štúdií o zmesi plynov a správanie plyny pri prechode cez steny kontajnera.
Z pozorovaní Thomasa Grahama o správaní plynov vo vzťahu k difúzii a výpotku môžeme zdôrazniť nasledujúce:
Plyn má vždy tendenciu prechádzať malými otvormi prítomnými v tuhej fáze;
Čím väčšie hmotnosť molekuly plyn, tým väčšie ťažkosti má pri prechode cez otvory pevnej hmoty;
Čím nižšia je hustota plynu, tým vyššia je rýchlosť jeho pohybu;
Čím vyššia je teplota, ktorej je plyn vystavený, tým vyššia je rýchlosť, ktorou sa šíri do okolia alebo prechádza otvorom;
- Plyn nikdy nezostane statický na konkrétnom mieste.
Difúzia
Difúzia je to fyzikálny jav, ktorý spočíva v schopnosti plynu difundovať (to znamená šíriť sa) po celom priestore oblasti alebo vo vnútri nádoby. Z tohto dôvodu môžeme povedať, že v priestore nie je plyn nikdy obmedzený na jediné miesto.

Zastúpenie výskytu vysielania
Okrem toho môžeme definovať difúzia
stále ako kapacita, ktorú musí jeden plyn miešať s druhým, ak je umiestnený v tej istej nádobe, a vytvára homogénnu plynnú zmes.Príkladom je, keď plyny vychádzajú z výfukov vozidla. Akokoľvek sú toxické, nespôsobujú krátkodobé poškodenie ľudí, pretože sa šíria po atmosférickom vzduchu a následne znižujú ich koncentráciu.
Výpotok
Výpotok je to fyzikálny jav, ktorý spočíva v prechode plynu cez otvory existujúce v stenách určitej nádoby, to znamená, že spočíva vo výstupe plynu z jedného prostredia do druhého.

Zastúpenie výskytu vyliatia
Príkladom je, keď sú balóny nafúknuté na večierok a na druhý deň sú všetky vypustené, a to všetko kvôli vzduchu unikajúcemu cez otvory obsiahnuté v balónoch.
Výpočty týkajúce sa difúzie a výpotku
Podľa rovníc navrhnutých Grahamom môžeme vypočítať rýchlosť, pri ktorej plyn funguje difúzia alebo výpotok. Podľa Grahama sú rýchlosti difúzie a efúzie dvoch plynov zmiešaných v nádobe vždy nepriamo úmerné druhej mocnine ich relatívnych hustôt alebo ich molárnych hmotností.
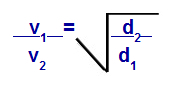
Grahamov zákon o hustote
v1 = rýchlosť (výpotok alebo difúzia) plynu 1 v zmesi;
v2 = rýchlosť (výpotok alebo difúzia) plynu 2 v zmesi;
d1 = hustota plynu 1 zmesi;
d2 = hustota plynu 2 v zmesi;
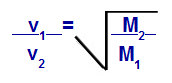
Grahamov zákon o molárnej hmote
v1 = rýchlosť (výpotok alebo difúzia) plynu 1 v zmesi;
v2 = rýchlosť (výpotok alebo difúzia) plynu 2 v zmesi;
M1 = molárna hmotnosť plynu 1 zmesi;
M2 = molárna hmotnosť plynu 2 v zmesi.
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm
