Oxidácia energie v alkíny je organická reakcia, ktorá nastane, keď sa alkín (uhľovodík, ktorý má trojitú väzbu medzi dvoma atómami uhlíka) pridá k kyslému roztoku s činidlo z baeyer (Manganistan draselný - KMnO4).
POZNÁMKA: Reakcia používateľa oxidácia energie sa môže uskutočňovať s dichrómanom draselným (K.2Cr2O7), a nielen manganistan draselný.
Kedykoľvek reakcia od sa uskutočňuje energetická oxidácia v alkynoch, produkty, ktoré môžu vzniknúť, sú karboxylové kyseliny, voda (jediná položka v ktorejkoľvek z nich) a oxid uhličitý (CO2).
Baeyerovo činidlo v kyslom prostredí
Keď sa Baeyerovo činidlo zmieša s vodou, v prítomnosti a kyselina (látka schopná uvoľňovať H ióny+), vzniká dvojka oxidy (oxid draselný a oxid manganičitý II) a rodiace sa kyslíky ([O]).

Mechanizmy oxidácie energie v alkynoch
1. mechanizmus: rozbitie trojitej väzby.
Na úvod je trojitá väzba napadnutá rodiacimi sa kyslíkami tvorenými Baeyerovým činidlom. Tento útok spôsobí úplné prerušenie trojitého puta.
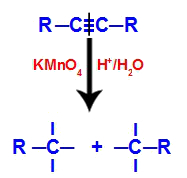
Porušenie trojitej väzby útokom rodiacich sa kyslíkov
Keď sa trojitá väzba rozbije, alkín sa rozdelí na dve časti. Na každom z uhlíkov, ktoré boli trojité, sa objavili tri voľné valencie.
2. mechanizmus: Interakcia hydroxylových skupín
Každá z voľných valencií na uhlíkoch, kde bola trojitá väzba, je obsadená hydroxylovými skupinami (OH), ktoré tvoria polyol (alkoholu s niekoľkými hydroxylovými skupinami).
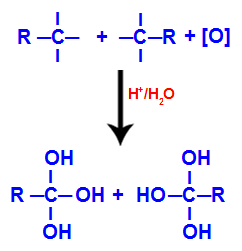
Tvorba polyolu s hydroxylovými skupinami po štiepení trojitou väzbou
POZNÁMKA: Ak je na uhlíku, kde bola trojitá väzba, pripojený atóm vodíka, dostane tento atóm vodíka vznikajúci kyslík a tiež vytvorí ďalšiu hydroxylovú skupinu.
3. mechanizmus: Tvorba molekúl vody
Ak má uhlík dve alebo viac OH skupín, stáva sa veľmi nestabilnou štruktúrou v dôsledku prítomnosti extrémne elektronegatíva. V dôsledku nestability teda molekula podlieha samodehydratácii, to znamená, že sa hydroxylová skupina viaže na hydrónium (H+) z inej hydroxylovej skupiny a vytvára vodu.

Tvorba molekúl vody z dvoch hydroxylov prítomných vo vytvorenom polyole
4. mechanizmus: Tvorba produktu
Po vytvorení molekúl vody uhlík stráca väzbu v dôsledku výstupu a hydroxyl a kyslík druhého hydroxylu tiež stráca väzbu, ktorá sa vytvárala s vodík. Preto sa medzi týmto uhlíkom a kyslíkom objaví dvojitá väzba, ktorá vytvorí karbonylovú skupinu (C = O) a stabilizuje obe.
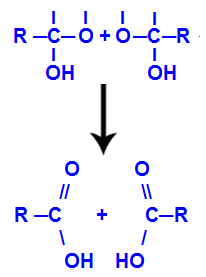
Tvorba karbonylu v dvoch štruktúrach získaných z alkínu
Príklad rovnice oxidácie energie Alkyne
Príklad: Energetická oxidácia But-1-ino
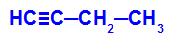
Štruktúrny vzorec but-1-ónu
Keď sa but-1-ín umiestni do média obsahujúceho Bayerovo činidlo, vodu a kyselinu, väzba sa pretrhne. trojitá medzi uhlíkmi 1 a 2, v dôsledku útoku rodiacich sa kyslíkov existujúcich v strede, ako je to v rovnici nižšie:
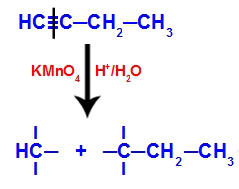
Prerušenie but-1-ročných spojení
Po rozbití trojitej väzby uhlíky 1 a 2 dostanú tri hydroxyly, ale uhlík 1 bude mať ešte jednu, pretože mala atóm vodíka (ktorý sa viaže na rodiaci sa kyslík) a tvorila dva polyoly (fragment 1 a 2).

Rovnica predstavujúca tvorbu polyolov
Hneď potom, ako sú polyoly nestabilné, dôjde k tvorbe molekúl vody z hydroxylov. Vo fragmente 1 sa objavuje molekula vody (pretože sú tam tri hydroxyly) a vo fragmente 2 sa objavujú dve molekuly (pretože sú tam štyri hydroxyly).
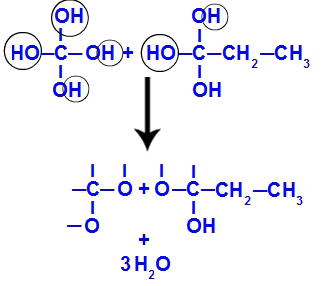
Tvorba molekúl vody z but-1-ínových fragmentov
Nakoniec dôjde k vytvoreniu dvojitej väzby medzi uhlíkmi, ktoré stratili hydroxylovú skupinu, a kyslíkami, ktoré stratili vodík, čo vedie k vzniku karbonylov.

Tvorba karbonylov vo buténových fragmentoch
Pomocou vyššie uvedenej rovnice vidíme, že z but-1-ínu vznikli karboxylové kyseliny a oxid uhličitý (CO2).
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcinos.htm

