Palivá používané vo väčšine automobilov sú benzín a etanol. Pri úplnom spaľovaní týchto dvoch palív sa vytvára oxid uhličitý (CO2 písm. G)) a vodu (H2O). Bohužiaľ však nedokonalé spaľovanie a nečistoty prítomné v alkohole a benzíne môžu vytvárať látky, ktoré veľmi znečisťujú životné prostredie. V prípade benzínu oxid uhoľnatý (COg)); uhľovodíky (zlúčeniny pozostávajúce z uhlíka a vodíka), ako je etán (C.2H6 (g)); a oxidy dusíka (NOX), hlavne oxid dusičitý (NO) a oxid dusičitý (NO2 písm. G)).
Aby sa zabránilo zvýšeniu znečistenia ovzdušia, všetky automobily potrebujú vybavenie tzv katalyzátor alebo katalyzátor, čo je zariadenie proti znečisťovaniu, ktoré má funkciu úpravy týchto plynov uvoľňovaných spaľovacím motorom a ich premeny na menej škodlivé plyny. Katalytické konvertory sa na tento účel používajú aj v niektorých priemyselných procesoch.
Uvedené znečisťujúce plyny opúšťajú motor a vstupujú do katalyzátora prechádzajúcim cez akýsi „úľ“, ktorých články sú obvykle vyrobené z keramického alebo kovového materiálu, ktorý je potiahnutý oxidom hlinitým (oxid hlinitý - Al
2O3). Tento voštinový tvar s malými kanálikmi je dôležitý, pretože poskytuje veľkú kontaktnú plochu pre plyny, vďaka čomu rýchlejšie reagujú.Skutočným katalyzátorom je ale kov, ktorý leží na vrchu oxidu hlinitého. Typickými použitými kovmi sú paládium, ródium, platina alebo molybdén. Môžete tiež tieto kovy zmiešať a použiť zliatiny. Napríklad v prípade benzínu sa zvyčajne používa zliatina paládia a tória; v prípade etanolu sa používa iná zliatina paládia a molybdénu. Tieto kovy vykonávajú heterogénnu katalýzu so znečisťujúcimi plynmi.
heterogénna katalýza je to typ reakcie, pri ktorej katalyzátor vytvára s reaktantmi (v tomto prípade znečisťujúcimi plynmi) viacfázový systém. Je to preto, že katalyzátor sa adsorbuje, to znamená, že zadržuje molekuly reaktantov na svojom povrchu, oslabuje ich väzby a umožňuje rýchlejšiu reakciu.
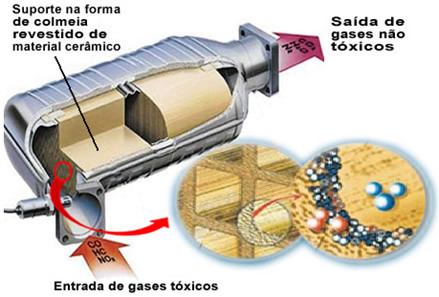
Výsledkom je, že kovy katalyzátora transformujú znečisťujúce látky, ako sú CO a NOX v netoxických plynoch, ako je CO2, H2O, O2 a nie2. Niektoré z týchto reakcií nájdete nižšie a všimnite si, že nimi dochádza k oxidácii uhľovodíkov a CO (odvodený z neúplného spaľovania) a tiež redukcia oxidov dusíka na plynný dusík (N2):
2 COg) + 2 NIEg) → 2 CO2 písm. G) + 1 s2 písm. G)
2 COg) + 1 O.2 písm. G) → 2 CO2 písm. G)
2C2H6 (g) + 7 O.2 písm. G) → 4 CO2 písm. G) + 6 H2O(v)
2 NIE2 písm. G) +4 COg) → 1 s2 písm. G) + 4 CO2 písm. G)
2 NIE2 písm. G) → 1 s2 písm. G) + 2 O.2 písm. G)
2 NIEg) → 1 s2 písm. G) + 1 O.2 písm. G)
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/conversor-catalitico.htm
