Halogenačné reakcie sú typom organickej substitučnej reakcie, to znamená tých, pri ktorých a atóm alebo skupiny atómov sú nahradené atómami alebo skupinami atómov inej molekuly organický.
Spravidla sa tento typ reakcie uskutočňuje s alkánmi a aromatickými uhľovodíkmi (benzén a jeho deriváty).
Halogenácia sa nazýva tak preto, lebo k nej dochádza pri jednoduchých látkach halogénov: F2Cl2, br2 Ahoj2. Najbežnejšie z nich sú však chlórovanie (Cl2) a bromácia (br2), pretože fluór je veľmi reaktívny a jeho reakcie sú výbušné a ťažko kontrolovateľné, dokonca ničia organické látky:
CH4 (g) + 2 F.2 písm. G) → C.s + 4 HFg)
Reakcie s jódom sú extrémne pomalé.
Ďalej sú uvedené hlavné typy halogenácie a niektoré príklady:
1. Halogenácia s alkánmi: Pretože alkány sú slabo reaktívne, ich halogenačné reakcie prebiehajú iba za prítomnosti slnečného žiarenia (λ), ultrafialového svetla alebo pri silnom zahriatí. Tento typ reakcie sa uskutočňuje za účelom získania alkylhalogenidu.
Príklad: monochlórovanie metánu:
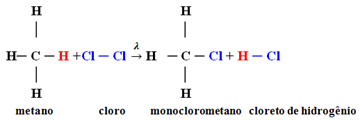
V tomto prípade k nej došlo z atómu vodíka metánu (CH
4) sa nahradí atómom chlóru, čím sa získa monochlórmetán. Ak by bolo chlóru príliš veľa, mohla by táto reakcia pokračovať v procese a nahradiť všetky vodíky v metáne.1.1. Halogenácia v alkánoch s viac ako 3 atómami uhlíka: Ak má alkán, ktorý má byť zreagovaný, najmenej 3 atómy uhlíka, nakoniec dostaneme zmes rôznych substituovaných zlúčenín. Nižšie uvádzame príklad monochlórovania metylbutánu:
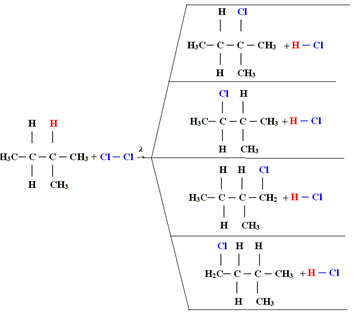
Množstvo každej zlúčeniny bude úmerné nasledujúcemu poriadku ľahkosti, s akým sa vodík uvoľňuje do molekuly:

V prípade uvedenom vyššie bude teda najväčšie množstvo 2-metyl-2-chlórbután a najmenšie množstvo 2-metyl-1-chlórbután.
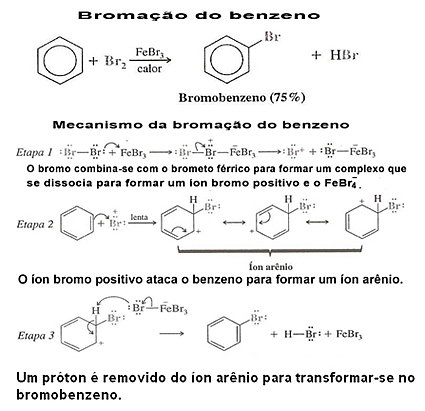
2. Halogenácia benzénu: Benzén za normálnych okolností nereaguje s chlórom alebo brómom. Pokiaľ sa však ako katalyzátor použije Lewisova kyselina (zvyčajne sa používa FeCl3, FeBr3 alebo AlCl3, všetko v bezvodej forme), benzén ľahko reaguje pri halogenačnej reakcii.
Chlorid a bromid železitý je možné získať pridaním železa do zmesi a týmto spôsobom reaguje s halogénom a vytvára Lewisovu kyselinu:
2 Fe + 3 Br2 → 2 FeBr3
Pozrite si príklad halogenácie benzénu a jeho mechanizmu:
3. Halogenácia benzénových derivátov:V takýchto prípadoch je substitúcia vedená substituentom alebo funkčnou skupinou, ktorá je pripojená k aromatickému jadru. Ak chcete zistiť, ako sa to stane, prečítajte si texty „Radikály v benzínovom kruhu„a“Elektronické efekty radikálov meta a orto-to-directors”.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/reacoes-organicas-halogenacao.htm

