THEosmóza a priechod rozpúšťadla, z menej koncentrovaného roztoku do koncentrovanejšieho roztoku prostredníctvom a polopriepustná membrána, kým tlak vyvíjaný na membránu nezabráni prechodu rozpúšťadla. Tento proces je určený na: vyrovnať koncentráciu roztoku.
Čítajte tiež: Rozpustená látka a rozpúšťadlo
osmotický tlak
THE osmotický tlak a tlak vyvíjaný na roztok s väčšou koncentráciou aby nedochádzalo k osmóze, teda aby rozpúšťadlo neprechádzalo cez polopriepustnú membránu.
Osmotický tlak sa používa v procesoch odsoľovanie vody, vynútenie procesu reverzná osmózačím sa spôsobí prechod rozpúšťadla z koncentrovanejšieho roztoku do menej koncentrovaného. Tento proces voláme reverzná osmóza. Na nasledujúcom obrázku je porovnanie týchto dvoch procesov:
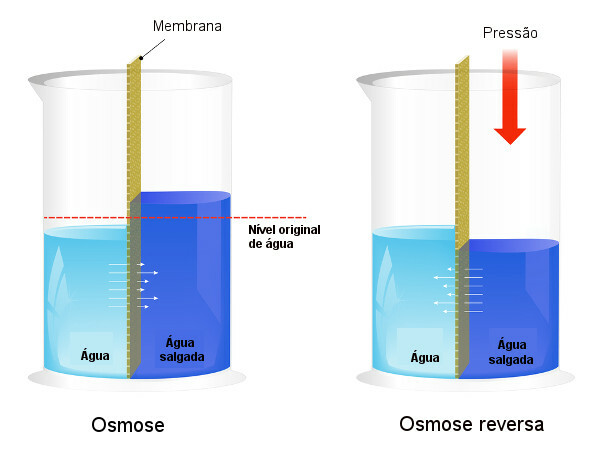
Upozorňujeme, že pri osmóze je priechod rozpúšťadla v smere najkoncentrovanejšieho roztoku a že pri reverznej osmóze je priechod v opačnom smere v dôsledku pôsobenia tlaku. Ak sa chcete dozvedieť viac informácií o tejto téme, prečítajte si náš text:
osmotický tlak.vedieť viac: Reverzná osmóza pri odsoľovaní morskej vody
rovnica osmotického tlaku
Osmotický tlak, predstavovaný písmenom pi (π) roztoku možno vypočítať podľa tejto rovnice:
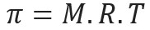
M = koncentrácia v mol / L
R = univerzálna konštanta dokonalých plynov
T = absolútna teplota v K
ako ostatní koligatívne vlastnosti, osmotický tlak závisí od koncentrácia roztoku, to znamená, čím vyššia je koncentrácia roztoku, tým väčší je vplyv osmózy na roztoky, a teda aj vyšší osmotický tlak.
Príklady
Osmóza sa v našom každodennom živote objavuje v rôznych časoch. Môžeme uviesť príklad proces solenia mäsa tvojmu ochrana. Vy mikroorganizmy ktoré by spôsobilo degradáciu mäsa stratiť voduzvnútra von, ktorá má koncentráciu soli, vďaka čomu jedlo vydrží dlhšie.
Kvôli soli sa tiež stáva, že listy šalátu vädnú za stratu vody z vnútornej strany ich bunky (druh menej koncentrovaného) pre temperované riešenie vo vonkajšom prostredí.
Osmóza je tiež dôležitá, keď hovoríme o krv človek. Hovoríme, že Červené krvinky a krv je jedna izotonické médium, to znamená, že majú rovnaký osmotický tlak, ktorý umožňuje ľahký vstup a výstup vody z bunky.
Keď sa však krv stane menej koncentrovanou ako vo vnútri červených krviniek (hypotonické médium), k prechodu vody dôjde ľahšie vo vnútri bunky, čím dôjde k jej úniku napučať až do prasknutia. Ak krv dosiahne vyššiu koncentráciu ako koncentrácia červených krviniek (hypertonické médium), krvinky vädnú, pretože strácajú vodu.

Z rovnakého princípu konzervácie mäsa vyplýva, že ochrana ovociav cukríkových kompótoch, ktorí konzervujú potraviny kvôli vysoká koncentrácia cukru v riešení.
Nasledujú ďalšie príklady, kde dochádza k osmóze:
- nárast miazgy vo vodivých nádobách rastliny;
- o hemodialýza;
- pri selektívnom prechode živín do buniek ľudského tela.
Ak chcete pochopiť, ako sa osmóza deje v živočíšnej bunke, v rastlinnej bunke a v ďalších biologických problémoch, prečítajte si: Osmóza: čo to je a ako sa vyskytuje v živočíšnej a rastlinnej bunke.
Autor: Victor Ferreira
Učiteľ chémie
