Analýza fyzikálnych a chemických vlastností zlúčenín, ktoré vykonávajú kovalentné väzby (zdieľaním elektrónov), nám ukazuje, že medzi týmito materiálmi sú veľké rozdiely. Ale predtým, ako sa pozrieme na tieto vlastnosti, pozrime sa, aký je rozdiel medzi molekulárnymi a kovalentnými látkami.
O molekulárne látky sú to tie, ktoré sa tvoria, keď sú atómy spojené pomocou kovalentných väzieb, čím vzniknú molekuly určeného počtu.
Kovalentná väzba však môže tiež vytvárať zlúčeniny v sieťovej štruktúre s veľmi veľkým a neurčitým počtom atómov, ktoré sú makromolekuly. Takéto látky sa nazývajú kovalentné zlúčeniny alebo kovalentné pevné látky v sieti. Niektoré príklady týchto zlúčenín sú: diamant (C), grafit (C), oxid kremičitý (SiO)2) a karbid kremíka (SiC).
Teraz sa pozrime na jeho hlavné vlastnosti:
- Fyzikálny stav pri izbovej teplote: Za okolitých podmienok sa nachádzajú molekulárne a kovalentné zlúčeniny v troch fyzikálnych stavoch (tuhé, kvapalné a plynné).
Príklady:
O Pevný: cukor (sacharóza), oxid kremičitý (piesok), diamant, grafit;
O Kvapalina: voda, acetón, etanol;
O Plynné: Sírovodík, plynný chlór, plynný bróm, plynný vodík.

- Teplota topenia a varu: Všeobecne platí, že teploty topenia a varu týchto látok sú menšie ako u iónových látok.
Kovalentné látky majú vyššie teploty varu ako molekulové, vždy nad 1 000 ° C. Je to tak preto, lebo jeho molekuly sú užšie spojené a vytvárajú kryštalické mriežky, preto je potrebné poskytnúť viac energie na to, aby zmenili svoj stav.
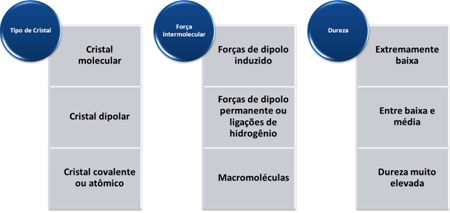
Dva body ovplyvňujú teplotu varu a teploty topenia kovalentných a molekulárnych zlúčenín: a molárna hmota a medzimolekulárna sila.
Čím väčšia je molárna hmotnosť, tým väčšia je zotrvačnosť molekuly a v dôsledku toho vyššia teplota varu a teploty topenia. Ak sú molárne hmotnosti aproximované, pozrieme sa na medzimolekulové sily. Najintenzívnejšou intermolekulárnou silou je sila vodíkových väzieb, ktorá vedie k vyššej teplote varu a teploty topenia. Medziprodukt je permanentný dipól a najslabší, ktorý vedie k nižšej teplote varu a teploty topenia, je indukovaný dipól.
- Elektrický prúd: V čistej forme kvapaliny ani pevné látky nevedú elektrický prúd.
Výnimkou je grafit, ktorý vedie elektrický prúd v pevnej forme, pretože jeho elektróny s dvojnou väzbou rezonujú, a preto majú určitú pohyblivosť.
- Rozpustnosť: Poláre sa rozpúšťajú v póly a nepoláre sa rozpúšťajú v nepoláre.
- Húževnatosť: Odolnosť kovalentných látok proti nárazu alebo mechanickému nárazu je nízka. Spravidla sú to krehké pevné látky, ako je to v prípade skla, ktoré je tvorené kremičitanmi sodnými a vápenatými.

- Húževnatosť: Všeobecne majú vysokú tvrdosť. S výnimkou grafitu, pretože jeho atómy uhlíka sú spojené s tromi ďalšími atómami uhlíka a vytvárajú šesťuholníkové platne s určitou pohyblivosťou, vďaka čomu je mäkký. Z tohto dôvodu sa dokonca používa ako mazivo.
Tvrdosť týchto látok sa líši podľa typu kryštálu, ako je uvedené v nasledujúcej tabuľke:
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/propriedades-dos-compostos-covalentes-moleculares.htm
