Uhličitany sú anorganické zlúčeniny tvorené iónovou väzbou kovu alebo polokovu s uhličitanovým aniónom, CO32-.
Uhlík je štvormocný, to znamená, že má štyri elektróny vo valenčnej škrupine a môže vytvárať štyri kovalentné väzby, aby boli stabilné, zatiaľ čo kyslík je bivalentný, má šesť elektrónov vo valenčnej škrupine a je schopný vytvoriť dve väzby, ktoré majú byť stabilné, s ôsmimi elektróny. Existuje teda silná tendencia k väzbe uhlíka na dva atómy kyslíka, z ktorých všetky sú stabilné (O ═ C ═ O → CO2).
Ale iný kyslík sa môže kombinovať s uhlíkom, pretože pomer iónových polomerov vedie ku koordinačnému číslu rovnému 3, ktoré vytvára štruktúru trojuholníkový, v ktorom je uhlík v strede, čím vytvára dvojitú väzbu s jedným z atómov kyslíka a dve jednoduché väzby s ďalšími dvoma kyslíky. Výsledkom sú dva prebytočné elektróny, pretože tieto dva kyslíky nie sú stabilné a je potrebné, aby každý z nich prijal jeden elektrón:
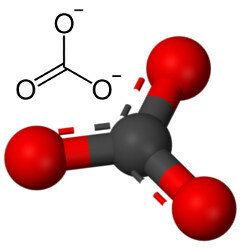
Uhličitanový anión je tvorený kovalentnými väzbami, ale jeho zlúčeninami, ktorými sú anorganické soli a minerály známe ako karbonáty, sú iónové, pretože tento radikál prijíma dva elektróny z nejakého kovu alebo polokovu, pričom vytvára a iónová väzba.
Tieto zlúčeniny sú nerozpustné vo vode, s výnimkou uhličitanu amónneho ((NH4)2CO3) a uhličitany tvorené s alkalickými kovmi (prvky rodiny 1: Li, Na, K, Rb, Cs a Fr). Takmer všetky sú biele pevné látky, ako je to znázornené na obrázku nižšie:

Dva najbežnejšie a najdôležitejšie každodenné príklady uhličitanov sú uhličitan sodný (Na2CO3) a uhličitan vápenatý (CaCO3). V prvom prípade patrí sodík do rodiny 1, ktorý má elektrón vo valenčnom obale a má tendenciu tento elektrón strácať, aby sa stal stabilným. Pretože uhličitanový anión musí prijímať dva elektróny, viaže sa na dva atómy sodíka:

Sóda je známejšia ako sóda alebo sóda, ktorá sa používa na výrobu mydiel, farbív, liekov, papiera a na úpravu vody v bazénoch. Ale jeho hlavné použitie je pri výrobe skla s uhličitanom vápenatým a pieskom.
Vápnik je rodina 2, ktorá má tendenciu strácať dva elektróny. Atóm vápnika sa teda viaže na uhličitanový radikál:

Uhličitan vápenatý je prítomný vo vápenci a mramore. O stalaktity a stalagmity ktoré existujú v jaskyniach, sú tvorené týmto uhličitanom; mušle, koralové útesy a vaječné škrupiny tiež. Keď bielime steny, kmene stromov a iné miesta, používame hydroxid vápenatý (Ca (OH)2), ktorý časom reaguje s atmosférickým oxidom uhličitým za vzniku uhličitanu vápenatého.

Uhličitany sú na zemskom povrchu veľmi časté, ako v prípade minerálov. Ich kryštalické mriežky sa môžu v priestore usporiadať dvoma spôsobmi: ortorombickou (ako je to v prípade minerálu aragonitu uvedeného vyššie spolu so vzorcom uhličitanu vápenatého) a romboedrický alebo trigonálny, ako je to v prípade kalcitu (ďalší minerál pozostávajúci z uhličitanu vápenatého).
Uhličitany reagujú v prítomnosti kyselín a uvoľňujú CO2, ktorý je ľahko viditeľný cez šumenie.
Autor: Jennifer Fogaça
Vyštudoval chémiu

