Hmota môže podstúpiť dva hlavné typy transformácií, fyzikálnu a chemickú. Fyzická premena je, keď sa nezmení podstata hmoty, to znamená jej zloženie. Napríklad keď sme vyrezali kus dreva, prešlo transformáciou, ale bol to fyzikálny jav, pretože stále ide o drevo, jeho konštitúcia je rovnaká ako na začiatku.
Na druhej strane, pri zmene povahy alebo zloženia hmoty nastáva chemická premena alebo jav. V tomto prípade sú počiatočné častice (ktoré môžu byť molekuly, atómy, iónové zhluky, ióny atď.) Podobné rozobraté a ich atómy sa znova usporiadajú, zhromažďujú sa nové molekuly, zhluky, atómy, ióny atď., to znamená nové látok. Toto je chemická reakcia.
Predstavte si napríklad, že prinesieme zapálenú zápalku blízko etylalkoholu. Vieme, čo sa stane: alkohol začne horieť. To znamená, že prechádza chemickou reakciou s kyslíkom vo vzduchu (O2) a zmení svoje zloženie a prestane byť etanolom (C.2H6O) a kyslík už tiež nebude mať pôvodné zloženie, z ktorého pochádzajú nové látky, ktorými sú oxid uhličitý (CO2) a vodu (H2O).

Alkohol pri horení - reakcia na spaľovanie
Pri chemických reakciách sa počiatočné látky nazývajú činidlá a koniec roka Produktya reakcie sú znázornené prostredníctvom chemické rovnice, ktoré majú nasledujúcu všeobecnú štruktúru:
ČINIDLÁ → VÝROBKY
Ak vezmeme do úvahy predchádzajúci príklad úplnej spaľovacej reakcie alkoholu (etanolu), máme nasledujúcu chemickú rovnicu:
Etanol + plynný kyslík → oxid uhličitý + voda
Táto chemická reakcia je ďalej znázornená pomocou atómov podľa Daltonovho modelu vo forme jednoduchých gúľ:
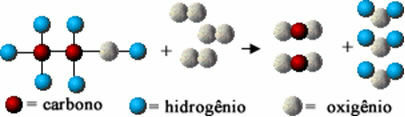
Modelové znázornenie reakcie spaľovania etanolu
Všimnite si, že počiatočné väzby medzi atómami boli prerušené, vytvorili nové väzby a objavili sa nové látky.
Chemické rovnice sa teda píšu pomocou vzorcov a symbolov, ktoré najlepšie zodpovedajú vyššie uvedenej schéme. V uvažovanom prípade (reakcia spaľovania etanolu) máme za to, že chemická rovnica je vyjadrená takto:
Ç2H5oh(?) + 3 O.2 písm. G) → 2 CO2 písm. G) + 3 H2O(v)
Existuje niekoľko vizuálnych faktorov, ktoré naznačujú, že došlo k chemickej reakcii, ktorými sú:
* Uvoľňovanie plynu;
* Zmena farby;
* Zrážanie;
* Vzhľad plameňa alebo svietivosti.
Dôležitými procesmi, ktoré sa vyskytujú v našom tele, v prírode a v priemyselných odvetviach, ako je výroba liekov a priemyselných potravín, sú chemické reakcie. Preto sú mimoriadne dôležité pre vznik a udržanie života.
Existuje niekoľko typov chemických reakcií, ktoré možno klasifikovať podľa rôznych kritérií, ale hlavné typy študované v chémii sú:
1. Anorganické reakcie: Zvyčajne sa klasifikujú podľa počtu vytvorených látok, počtu reagencií a prítomnosti alebo neprítomnosti jednoduchých a zložených látok. Existujú štyri hlavné typy anorganických reakcií:
1.1. Syntéza alebo adičné reakcie;
1.2. Reakcia na rozklad alebo analýzu;
1.3. Jednoduchá výmena, vytesnenie alebo redoxná reakcia;
1.4. Reakcia dvojitej výmeny alebo metatézy;
2. Organické reakcie: Tieto zahŕňajú zlúčeniny uhlíka. Spravidla sa klasifikujú do troch hlavných typov:
2.1. Reakcie pridania;
2.2. Reakcie na výmenu;
2.3. Vylučovacie reakcie.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-reacao-quimica.htm

