Elektrolýza je to spontánny proces, tj. proces, ktorý sa nevyskytuje prirodzene, pri ktorom sa vytvárajú látky pomocou elektrického výboja v zlúčeninách rozpustených alebo rozpustených vo vode. V tomto procese sa elektrický prúd dostane do sklenenej nádoby (elektrolytickej nádrže), ktorá má dve inertné elektródy (ktoré netrpia alebo oxidácia ani zníženie) tvorené grafitom alebo platinou. Tieto elektródy sú pripojené k elektrickému zdroju (zvyčajne a bubny) a ponorené do soli alebo bázy roztavenej alebo rozpustenej vo vode. Rovnako ako batéria, elektrolýza má katódu (pri ktorej dochádza k redukcii) a anódu (pri ktorej dochádza k oxidácii).
Zhrnutie
Elektrolýza je proces, ktorý nie je spontánny;
Môžu sa vytvárať jednoduché alebo zložené látky;
Môže sa vyskytnúť pri roztavenej látke (magmatická elektrolýza);
Môže sa vyskytnúť s rozpustenou látkou rozpustenou vo vode (vodná elektrolýza);
Katión vždy podlieha redukcii na katóde;
Anión vždy podlieha oxidácii na anóde.
Pozri tiež:Získavanie hliníka elektrolýzou

Druhy elektrolýzy
Jedná sa o elektrolýzu, ktorá nastáva, keď sa vykonáva elektrický výboj na roztavenej iónovej zlúčenine. Iónová zlúčenina je zlúčenina tvorená iónovou väzbou, ako je napríklad a soľ alebo a základňa anorganické. Keď hovoríme o roztavenej zlúčenine, máme na mysli zlúčeninu, ktorá prechádza z pevného do kvapalného stavu.
- Príklad magmatickej elektrolýzy
Keď uskutočňujeme fúziu chloridu draselného (KCl), táto soľ prechádza disociačným procesom a uvoľňuje katión draselný (K+) a jodidový anión (l-).

Disociačná rovnica pre chlorid draselný
Keď elektrický prúd dosiahne s týmito iónmi elektrolytický článok, katión draslíka sa zníži za vzniku kovového draslíka (K) a jodidový anión sa oxiduje za vzniku pevného jódu (I2).
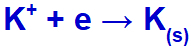
Rovnica tvorby pevného draslíka
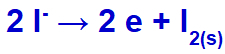
Rovnica tvorby tuhého jódu
Jedná sa o elektrolýzu, ktorá nastáva, keď sa elektrický výboj vykonáva na vodnom roztoku (má vodu) tvorenom soľou alebo anorganickou bázou.
- Príklad vodnej elektrolýzy
Keď rozpustíme chlorid sodný vo vode, disociuje sa a voda prechádza ionizáciou:

Rovnice ionizácie vody a disociácie chloridu sodného
Ako katión sodný (Na+) patrí do rodiny IA, hydróniový katión (H+) prechádza výbojom a podrobuje sa redukcii, pri ktorej vzniká plynný vodík (H2).
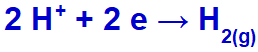
Rovnica tvorby vodíka
Ako chlorid (Cl-) nie je okysličený (nemá kyslík) a nie je fluorid (F.-), vylučuje sa, oxiduje a vytvára plynný chlór (Cl2).

Rovnica tvorby chlóru
Selektívny iónový výboj
Počas procesu elektrolýzy vo vodnom prostredí (roztok tvorený vodou a rozpustenou látkou) budeme mať vždy dva katióny: hydrónium, z vody a akékoľvek ďalšie, z disociácia solí (príklad rozpustenej látky). Budeme mať tiež dva anióny: hydroxyl, ktorý pochádza z vody, a ďalší, ktorý pochádza zo soli.

Ióny z ionizácie vody a disociácie solí
- Selektívny výboj pre katióny a anióny
Ak katión z rozpustenej látky patrí do rodiny IA, IIA alebo IIIA, potom sa hydrónium (H+) sa zníži;
Pokiaľ katión pochádzajúci z rozpustenej látky nepatrí do vyššie spomenutých rodín, bude trpieť redukciou.
Ak má anión z rozpustenej látky vo svojom zložení kyslík alebo je to fluorid (F.-), hydroxid (OH.)-) podstúpi oxidáciu;
Pokiaľ anión z rozpustenej látky nemá vyššie uvedené vlastnosti, podrobí sa oxidácii.
Je známe, že voda má schopnosť samoionizácie, pri ktorej sa vytvárajú ióny hydrónia (H+) a hydroxid (OH.)-), ale táto ionizácia je dosť obmedzená. Túto skutočnosť dokazuje neúčinnosť čistej vody pri vedení elektrického prúdu.
Ako napr elektrolýza zahŕňa elektrický výboj, na uskutočnenie elektrolýzy vody je potrebné rozpustiť rozpustenú látku, ktorý uprednostňuje selektívny výboj hydrónia a hydroxidu (ako je vidieť v téme výboj) selektívne).
Ak pridáme síran sodný (Na2IBA4) napríklad budeme mať sodné katióny v strede (Na+) a hydrónium (H+), ako aj hydroxidové anióny (OH-) a síran (SO.)4-2). Keď teda do elektrolytickej nádrže dorazí elektrický prúd:
hydrónium bude vypúšťané, redukčne, pretože sodík patrí do rodiny IA;
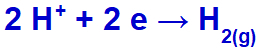
Rovnica tvorby vodíka
hydroxid podstúpi výboj, oxiduje, pretože síran má vo svojom zložení kyslík.
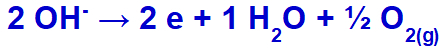
Rovnica tvorby kyslíka
Keď sa dva ióny (katión a anión) prichádzajúce z vody vybili, hovoríme, že došlo k elektrolýze vody.
Pozri tiež: Kvantitatívne aspekty elektrolýzy
Výroba jednoduchých látok, ako je plynný vodík (H2), plynný kyslík (O2) atď.;
Výroba zložených látok, ako sú hydroxid sodný (NaOH), kyselina sírová (H2IBA4) atď;
Potiahnutie časti konkrétnym kovom, napríklad meďou (meď) a zlatom (pozlátenie);
Slúži na odstránenie určitého kovu z rudy.
Vyriešené úlohy z elektrolýzy
Príklad 1 - (Vunesp) Vodný roztok CuCℓ2 sa podrobí elektrolýze s použitím platinových elektród. Správne tvrdenie je:
a) Na katóde dochádza k redukcii iónov Cu2+.
b) Na anóde dochádza k oxidácii iónov Cu2+.
c) Na katóde sa vytvára plynný chlór.
d) Časť platinovej anódy sa rozpustí za vzniku Pt2+.
e) Produkty tejto elektrolýzy by sa líšili, ak by išlo o elektrolýzu CuCl2 boli ohnivé (fúzie).
a) Správne. Keď CuCl2 je rozpustený vo vode, máme hydroniové katióny (H+) a meď II (Cu+2). Pretože katión medi II nepatrí do rodín IA, IIA a IIIA, je redukovaný.
b) Falošné, pretože chloridový anión (Cl) sa oxiduje na anóde-), ktorý vo svojom zložení nemá kyslík a nie je fluorid (F.-).
c) Falošné, pretože k redukcii katiónu medi II dochádza na katóde, preto dochádza k tvorbe kovového medi.
d) Falošné, pretože platinové alebo grafitové elektródy pri elektrolýze vedú iba elektrinu, nezúčastňujú sa na tomto procese.
e) Falošné, pretože magmatická elektrolýza chloridu meďnatého (CuCl2) by predstavoval úplne rovnaké produkty ako vodný roztok, pretože prítomnými iónmi by bola meď II (Cu+2) a chlorid (Cl-1).
Príklad 2 (UFRN) Zvážte nasledujúce systémy:
I. Roztavený chlorid sodný;
II. Vodný roztok chloridu sodného;
III. Tavený hydroxid sodný;
IV. Vodný roztok hydroxidu sodného.
Medzi látky, ktoré môžu pri elektrolýze poskytnúť sodík, patria:
a) iba ja a II.
b) iba ja a III.
c) iba II a IV.
d) iba III a IV.
e) I, II, III a IV.
Systémy, ktoré dodávajú kovový sodík ako produkt na katóde, sú I a III.
I- Jediným katiónom prítomným v médiu je katión sodný, preto iba redukuje a vytvára kovový sodík.
II- Tento systém neposkytuje kovový sodík, pretože chlorid sodný bol rozpustený vo vode, takže v strede máme prítomnosť katiónov sodíka (Na+) a hydrónium (H+) - toto je ten, kto trpí redukciou, pretože sodík patrí do rodiny IA.
III - Jediným katiónom prítomným v médiu je katión sodný (pretože materiál bol podrobený fúzii), preto iba podlieha redukcii a vytvára kovový sodík;
IV- Tento systém neposkytuje kovový sodík, pretože hydroxid sodný bol rozpustený vo vode, takže v strede máme prítomnosť katiónov sodíka (Na+) a hydrónium (H+) - toto je ten, kto trpí redukciou, pretože sodík patrí do rodiny IA.
Podľa mňa. Diogo Lopes Dias

