THE cestovinyatómový, ako už názov napovedá, ide o hmotnosť atómu, zvyčajne symbolizovanú „mThe“ alebo „MA“. Keďže je však atóm extrémne malá entita, pre ľudské oči neviditeľná, nie je možné zmerať jeho hmotnosť napríklad pomocou váh. Takže vedci určili hmotnosť atómov porovnaním s hmotnosťou iných atómov.
To sa robí aj s ostatnými jednotkami. Napríklad jednotkou hmotnosti je štandardný kilogram, čo zodpovedá valcu s výškou a priemerom 3,917 cm, ktorý je vyrobený z 10 % irídia a 90 % platiny. Takže slúži ako porovnanie. Ak napríklad „odvážime“ predmet na váhe a zistíme, že jeho hmotnosť je 10 kg, znamená to, že jeho hmotnosť je 10-krát väčšia ako zvolený štandard: 1 kg.
Neprestávaj teraz... Po reklame viac ;)
To isté platí pre atómy. Vybraný štandard bol uhlík-12 a tento atóm mal svojvoľne pridelenú hmotnosť 12 u. „u“ je jednotka atómovej hmotnosti, a preto je ekvivalentná 1/12 hmotnosti atómu uhlíka.
Napríklad, keď povieme, že atómová hmotnosť vodíka sa rovná 1 u, znamená to, že je to ako keby ak uhlík rozdelíme na 12 častí, hmotnosť jednej z týchto častí je ekvivalentná hmotnosti atómu vodík. Ďalším príkladom je síra, jej atómová hmotnosť je 32 u, čo znamená, že jej hmotnosť je 32-krát väčšia ako 1/12 hmotnosti
12Ç.1 u = 1/12 hmotnosti 1 atómu uhlíka 12

Atómová hmotnostná jednotka je 1/12 hmotnosti uhlíka-12
Molekulová hmotnosť látok je súčtom atómových hmotností prvkov. Napríklad atómová hmotnosť kyslíka sa rovná 16 u, takže molekulová hmotnosť molekuly plynného kyslíka (O2) sa rovná 32u.
Keďže laboratórne techniky sú v súčasnosti veľmi pokročilé, existujú zariadenia, ktoré presne merajú atómovú hmotnosť prvkov, ako napríklad hmotnostný spektrometer. Teda je to možné poznať 1 u sa rovná 1,66054. 10-24 g.
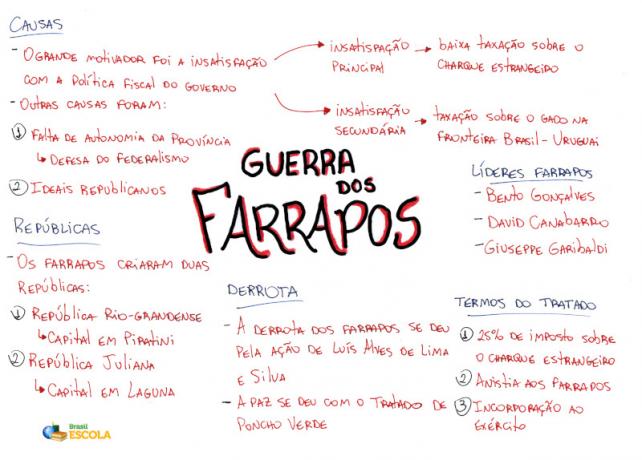
Myšlienková mapa: Atómová hmotnosť

*Ak si chcete stiahnuť myšlienkovú mapu vo formáte PDF, Kliknite tu!
Pretože atómové hmotnosti sú určené s veľkou presnosťou, sú uvedené v periodickej tabuľke vo forme desatinných čísel. Ale keď ideme robiť výpočty, zvyčajne používame zaokrúhlené číslo, s výnimkou experimentov, ktoré musia byť veľmi presné. Napríklad, ak sa pozriete na periodickú tabuľku, uvidíte, že atómová hmotnosť kyslíka sa rovná 15 999 u, ale vo výpočtoch vo všeobecnosti používame hodnotu 16 u. To sa deje aj s uhlíkom, ktorého atómová hmotnosť je daná 12,01 u, ako je uvedené nižšie:
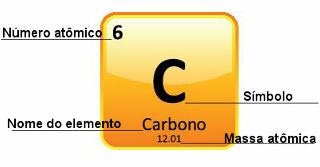
Zastúpenie uhlíka v periodickej tabuľke
Prvky, ktoré sa objavujú v periodickej tabuľke, sú v skutočnosti váženým priemerom všetkých prirodzených izotopov prvku. Atómová hmotnosť uvedená v tabuľke je teda tiež priemerom atómových hmotností týchto prvkov. Napríklad chlór (C2) má dva prirodzené izotopy, 35 a 37, ktorých príslušné percentá v prírode sú 75,76 % a 24,24 %. Atómové hmotnosti každého z týchto izotopov sú rozdielne, pričom atómová hmotnosť Cy-35 je 34,96885 u a atómová hmotnosť Cy-37 je 36,96590.
Týmto spôsobom sa vypočíta atómová hmotnosť prvku s prihliadnutím na hmotnosť každého izotopu a množstvo, s akým sa vyskytuje v prírode. V prípade chlóru máme:
Atómová hmotnosť prvku chlór = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Atómová hmotnosť prvku chlór = 35,45
Toto je hodnota atómovej hmotnosti chlóru, ktorá sa objavuje v periodickej tabuľke.
* Myšlienková mapa od Me. Diogo Lopes
Autor: Jennifer Fogaça
Vyštudoval literatúru