Kp je skratka používaná na určenie konštanta rovnováhy z hľadiska parciálnych tlakov. Táto konštanta pracuje napríklad s hodnotami plynných účastníkov rovnováhy v jednotke atm.

Rovnica predstavujúca chemickú reakciu s plynnými zložkami
V tejto rovnici sú všetci účastníci plynní, takže keď má zúčastnený plyn a parciálny tlak v zmesi, je reprezentovaný skratkou pX.
Pri zostavovaní rovnice chemickej rovnováhy (v zmysle koncentrácie) sa produkty musia umiestniť do čitateľa a reaktanty do menovateľa:
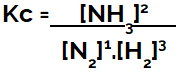
Kc vyjadrenie rovnováhy tvorby amoniaku
vyjadrenie rovnovážna konštanta z hľadiska tlaku (Kp) nasleduje vzor Kc, to znamená, že parciálne tlaky činidiel sú umiestnené v menovateli a parciálne tlaky produktov v čitateli:
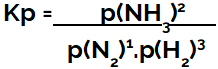
Kp vyjadrenie rovnováhy tvorby amoniaku
Pozorovanie: Ak je reakčná rovnica chemická bilancia nepredstavujú žiadneho plynného účastníka, automaticky sa neprezentuje Kp.
Príklad: (PUC-MG) Pre reakciu: 2 CO(g) + O2(g)? 2 CO2(g), parciálne tlaky CO(g) to je2(g) v rovnováhe sú 0,2 atm a 0,4 atm. Celkový tlak v systéme je 1,4 atm. Hodnota Kp lebo reakcia je:
a) 56,2
b) 40,0
c) 35.6
d) 28.4
e) 25.6
Údaje poskytnuté cvičením sú:
Parciálny tlak oxidu uhoľnatého (pCO) = 0,2 atm;
Parciálny tlak oxidu uhoľnatého (pO2) = 0,4 atm;
Celkový tlak = 1,4 atm;
Na určenie Kp tohto systému musíme vykonať nasledujúce kroky:
1. krok: Určite parciálny tlak oxidu uhoľnatého (pCO2).
Nezabudnite, že celkový tlak (pt) je súčtom všetkých parciálnych tlakov:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0,8 atm
2. krok: Určte Kp cvičenia.
Na to stačí použiť hodnoty vo vyjadrení rovnovážnej konštanty Kp:
Kp = (pCO2)2
(pCO)2.(prach2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Od mňa, Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm
