Atóm je základná jednotka hmoty a najmenšia frakcia schopná identifikovať chemický prvok, pretože si zachováva svoju identitu. Pojem atóm je odvodený z gréčtiny a znamená nedeliteľný.
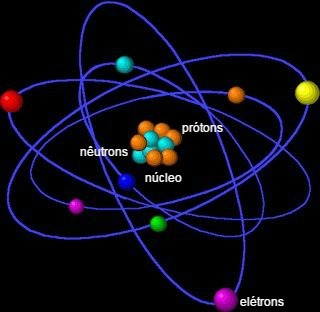
Skladá sa z jadra, ktoré obsahuje neutróny a protóny, a elektrónov, ktoré obklopujú jadro.
štruktúra atómu
Atóm je tvorený malými časticami, nazývanými tiež subatomárne častices: elektróny, protóny a neutróny.
Väčšina hmotnosti atómu je sústredená v jadre, malej, hustej oblasti. Jeho najväčší objem sa nachádza v elektrosfére, mieste prázdnych priestorov, pretože elektróny obiehajú okolo jadra.
elektróny
O elektrón má záporný elektrický náboj (-1) a takmer žiadnu hmotnosť, pretože má hodnotu 9,11 x 10-28 g e je asi 1840-krát menšie ako hmotnosť jadra. Sú to drobné častice, ktoré sa veľmi rýchlo otáčajú okolo atómového jadra.
Elektróny, ktoré sa nachádzajú v najvzdialenejších oblastiach atómu, sú zodpovedné za tvorbu chemických väzieb, ktoré sa vyskytujú darovaním, príjmom alebo zdieľaním elektrónov.
protóny
O protón má kladný elektrický náboj (+1) rovnakej absolútnej hodnoty ako náboj na elektrónoch. Týmto spôsobom majú protón a elektrón tendenciu vzájomne sa elektricky priťahovať.
Prostredníctvom protónov je možné rozlíšiť chemické prvky, pretože každý atóm prvku má vo svojom jadre definovaný počet protónov, ktorý sa nazýva atómové číslo.
neutróny
O neutrón nemá vôbec žiadny náboj, to znamená, že je elektricky neutrálny. Spolu s protónmi tvorí atómové jadro, ktoré prenáša celú hmotnosť atómu (99,9%). Protón aj neutrón majú hmotnosť približne 1,67 x 10-24 g. Táto hodnota predstavuje jednotku atómovej hmotnosti 1 μ.
Neutrón poskytuje stabilitu atómovému jadru, pretože jadrová sila spôsobuje, že je priťahovaný k elektrónom a protónom.
Iba atóm vodíka nemá neutróny, je tvorený iba elektrónom otáčajúcim sa okolo protónu.
V nasledujúcej tabuľke nájdete a abstraktné s informáciami o subatomárnych časticiach.
| Častica | Symbol |
Cestoviny (v jednotke atómová hmotnosť) |
Poplatok (v jednotke elektrický náboj - u.c.e) |
Poloha |
|---|---|---|---|---|
| Protón | +1 | jadro | ||
| Neutrón | 0 | jadro | ||
| Elektrón | -1 | elektrosféra |
Atóm v základnom stave je elektricky neutrálny, pretože počet protónov sa rovná počtu elektrónov a opačné náboje, kladné a záporné, sa navzájom rušia.
Napríklad sodík (Na) má atómové číslo 11, to znamená, že jeho jadro má 11 protónov. V dôsledku toho existuje 11 elektrónov v elektrosfére atómu tohto prvku.
Prečítajte si viac o atómová štruktúra.
atómové zloženie
Ako sme videli, atóm je tvorený malou a hustou centrálnou oblasťou nazývanou jadro a okolo nej je a elektrosféra, kde sa nachádzajú elektróny, ktoré možno rozdeliť na elektronické vrstvy, energetické podúrovne a atómové orbitaly.
elektronické vrstvy
atóm predstavuje úrovne energie, ktoré zodpovedajú siedmim vrstvám okolo jadra a sú v nich elektróny, ktoré okolo neho obiehajú. Vrstvy sa nazývajú K, L, M, N, O, P a Q.
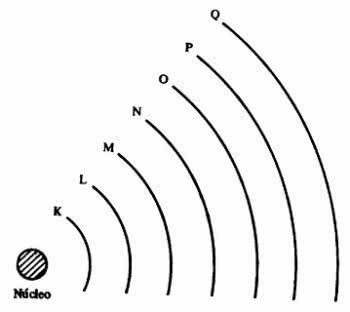
Každá škrupina môže obsahovať určitý počet elektrónov, ako je uvedené v nasledujúcej tabuľke.
| Úroveň energie | elektronická vrstva | Maximálny počet elektrónov |
|---|---|---|
| 1º | K | 2 |
| 2º | Ľ | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | O | 32 |
| 6º | P | 18 |
| 7º | Q | 8 |
Napríklad atóm hélia (He) má atómové číslo 2, a preto má v jadre 2 protóny. V dôsledku toho sú v elektrosfére atómu iba 2 elektróny, ktoré sú umiestnené v prvom a jedinom elektronickom obale atómu, v obale K, ktorý zodpovedá prvej energetickej úrovni.
Energetické úrovne
Úrovne energie obsahujú podúrovne, ktoré sú reprezentované s, p, d, f. Každá podúroveň pojme maximálny počet elektrónov, ktoré sú 2, 6, 10 a 14.

S týmito informáciami je možné elektronická distribúcia atómu a poznať polohu najvzdialenejšieho a najenergetickejšieho elektrónu.
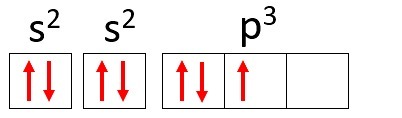
Príklad: Dusík (N)
Atómové číslo: 7
Elektronický rozvod: 1 s2 2 s2 2 s3
Atóm dusíka má dve energetické hladiny, K a L a jeho 7 elektrónov obsadzuje podúrovne s a p.
K: s2 = 2 elektróny
L: s2 + str3 = 5 elektrónov
Upozorňujeme, že obal L môže obsahovať až 8 elektrónov, ale v atóme dusíka je v ňom iba 5 elektrónov.
atómové orbitaly
Orbitaly charakterizujú oblasť, ktorá s najväčšou pravdepodobnosťou nájde elektrón v energetickej podúrovni (s, p, d, f) v elektronickom obale (K, L, M, N, O, P, Q).
- s podúroveň: má 1 orbitál, ktorý pojme až 2 elektróny
- p podúroveň: má 3 orbitaly, ktoré obsahujú až 6 elektrónov
- Podúroveň d: má 5 orbitálov, ktoré obsahujú až 10 elektrónov
- Podúroveň f: má 7 orbitálov, ktoré obsahujú až 14 elektrónov
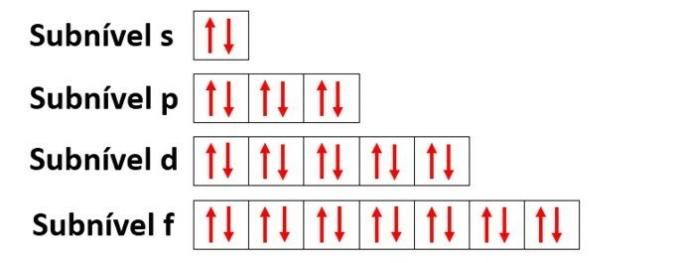
Ak by sme opäť použili príklad dusíka a distribuovali by sme jeho 7 elektrónov na atómových orbitáloch, mali by sme:
Typy atómov
Pri pozorovaní počtu protónov, neutrónov a elektrónov môžeme atómy porovnávať a klasifikovať ich izotopy, izobary a izotóny.
Chemický prvok možno definovať ako skupinu atómov s rovnakým počtom protónov. Tieto atómy sa nazývajú izotopy, pretože majú rovnaké atómové číslo a rôznu hmotnosť.
Napríklad v prírode existujú 3 izotopy prvku vodík (H): protium , deutérium
a trícium
.
Atómy rôznych chemických prvkov možno klasifikovať ako izotóny, ak majú rôzne atómové čísla a hmotnosti, ale rovnaký počet neutrónov.
Izobary sú atómy rôznych prvkov, to znamená, že majú odlišné atómové číslo, ale rovnaké hmotnostné číslo.
Prečítajte si viac o izotopy, izobary a izotóny.
Atómové modely (atómové modely)
Grécky filozof Aristoteles (384 a.) Ç. - 322 a. C) pokúsil sa vysvetliť zloženie všetkých látok z prvkov zem, vzduch, oheň a voda.
Democritus (546 a. C - 460 a. C), grécky vedec a matematik, formuloval myšlienku, že existuje obmedzenie pre malú veľkosť častíc. Povedal, že sa stanú tak malými, že ich už nebude možné rozdeliť. Túto časticu nazval „atómom“.
Po väčšinu 19. storočia to bol Daltonov atómový model, Anglický vedec, ktorý navrhol atómovú teóriu, ktorá išla ďaleko za hranice myslenia starcov.
Táto teória hovorí, že všetky látky sú tvorené malými nedeliteľnými časticami nazývanými atómy, ktoré by boli ako biliardové gule. Postupom štúdií o štruktúre hmoty sa zistilo, že atóm tvoria ďalšie malé častice, ktoré sa nazývajú subatomárne častice.
S objavom elektrónu thomson formuloval model známy ako hromadný puding, ktorý opísal atóm ako pozitívnu guľu so záporne nabitými elektrónmi zabudovanými do jej povrchu.
Pomocou experimentov fyzik Rutherford zistili, že atóm mal dutiny a elektróny okolo extrémne malého pozitívneho jadra. Rutherford teda navrhol jadrový model, ktorý predstavuje atóm.
Bohr vylepšil model navrhnutý Rutherfordom zistením, že elektróny sa netočia okolo jadra náhodne, ale na konkrétnych dráhach. Tento model sa stal známym ako planetárium.
Prečítajte si tiež o:
- Atómové modely
- Thomsonov atómový model
- Bohrov atómový model
- Rutherfordov atómový model
- Vývoj atómových modelov