THE osmotický tlak je to koligatívna vlastnosť, ktorá zodpovedá tlaku, ktorý musí byť vyvíjaný na systém, aby sa zabránilo spontánnemu výskytu osmózy.
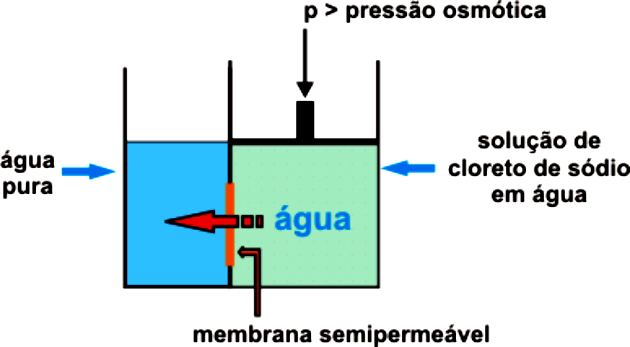
Osmóza je prechod vody z menej koncentrovaného (hypotonického) do koncentrovanejšieho (hypertonického) média cez polopriepustnú membránu, kým sa nedosiahne rovnováha.
Aby sa zabránilo spusteniu a prirodzenému priebehu osmózy, je potrebné vyvinúť vonkajší tlak na koncentrovanejší roztok, ktorý zabráni prechodu rozpúšťadla do koncentrovanejšieho média. To je osmotický tlak.
Čím je roztok koncentrovanejší, tým vyšší by mal byť osmotický tlak. Preto je osmotický tlak úmerný koncentrácii rozpustenej látky.
Ako vypočítať osmotický tlak?
Každé riešenie má inú hodnotu osmotického tlaku. Osmotický tlak možno vypočítať z nasledujúceho vzorca:
π = M. A. T. i
Kde máme nasledujúce premenné:
π = osmotický tlak;
M = koncentrácia v mol / L;
R = univerzálna plynová konštanta, ktorej hodnota zodpovedá 0,082 atm. Ľ mol
T = teplota v absolútnej stupnici (Kelvin);
i = Van’t Hoffov faktor, ktorý zahŕňa vzťah medzi celkovým počtom konečných a počiatočných častíc v iónových roztokoch.
Cvičenie vyriešené
1. (Puccamp-SP) 0,30 M roztok glukózy sa príležitostne používa v intravenóznej injekcii, pretože má osmotický tlak blízky tlaku krvi. Aký je osmotický tlak uvedeného roztoku v atmosfére pri 37 ° C?
a) 1,00.
b) 1,50.
c) 1,76.
d) 7,63.
e) 9,83.
Vzhľadom na údaje poskytnuté v otázke máme:
M = 0,30 mol / L;
R = 0,082 atm. Ľ mol-1. K-1
T = 37 ° + 273 = 310 K.
Teraz musíte tieto hodnoty použiť na vzorec na výpočet osmotického tlaku:
π = M. A. T. i
π = 0,30. 0,082. 310
π = 7,63 atm (Alternatívne)
Klasifikácia riešení
Roztoky možno rozdeliť do troch typov podľa osmotického tlaku:
- hypertonické riešenie: Má vyšší osmotický tlak a koncentráciu rozpustenej látky.
- izotonické riešenie: Keď majú roztoky rovnaký osmotický tlak.
- hypotonické riešenie: Má nižší osmotický tlak a koncentráciu rozpustenej látky.

Dôležitosť osmotického tlaku pre živé bytosti
Fyziologický roztok je látka pripravovaná na princípoch osmotického tlaku. Mal by sa aplikovať pri osmotickom tlaku, ktorý sa rovná tlaku v tele, čo zabráni Červené krvinky netrpia hemolýzou alebo sa scvrkávajú.
Osmotický tlak krvi je približne 7,8 atm. Pre správne fungovanie organizmu preto musia mať červené krvinky rovnaký osmotický tlak, ktorý zaisťuje normálny tok vody do a z buniek.
V prípade dehydratácie je napríklad indikované použitie soľného roztoku, ktorý musí byť izotonický vo vzťahu k krvným bunkám a iným telesným tekutinám.
Fyziologický roztok má funkciu navrátenia osmotickej rovnováhy do tela. Je to preto, že počas dehydratácie sa krv stáva koncentrovanejšou ako vnútro buniek, čo vedie k ich chradnutiu.
Osmóza a reverzná osmóza
Ako sme videli, osmóza je to proces prechodu vody z hypotonického do hypertonického prostredia polopriepustnou membránou, kým sa nedosiahne rovnováha medzi koncentráciami.
Medzitým reverzná osmóza je to proces oddeľovania látok cez membránu, ktorá zadržiava rozpustenú látku. Rozpúšťadlo prúdi z koncentrovanejšieho média do menej koncentrovaného média a je izolované z rozpustenej látky membránou, ktorá umožňuje jej prechod.
To sa deje iba v dôsledku vyvíjaného tlaku, vďaka čomu polopriepustná membrána umožňuje iba priechod vody a zadržiava rozpustenú látku. Tento tlak musí byť väčší ako prirodzený osmotický tlak.
Napríklad, ak je aplikovaný osmotický tlak väčší ako je potrebné, dôjde k reverznej osmóze. Tok teda bude prechádzať z média s najvyššou koncentráciou do média s najnižšou koncentráciou.