Hybridizácia uhlíka typu sp2 nastáva, keď má dvojitú väzbu a dve jednoduché väzby alebo väzbu pí (π) a tri väzby sigma (σ). V skutočnosti sp hybridizácia2 vzniká medzi atómami, ktoré vytvárajú dvojitú väzbu.
Príkladom takejto molekuly je formaldehyd (CH2O). Všimnite si jeho štruktúru nižšie:
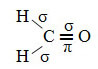
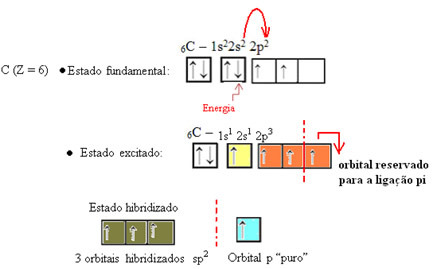
Ako je vidieť v texte „hybridizácia typu sp3”, Uhlíková hybridizácia nastáva, keď elektrón z podúrovne 2s prijme energiu a je„ transportovaný “do 2p podúrovňa, a teda pochádzajú 4 hybridizované orbitaly zo „zmesi“ atómových orbitalov čistý.
V prípade formaldehydu vieme, že tu bude väzba pí, takže jeden z týchto hybridizovaných orbitálov je vyhradený pre túto väzbu, zatiaľ čo ďalšie tri tvoria väzby sigma:
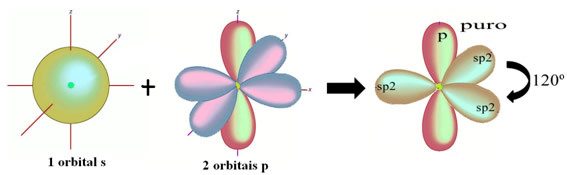
Atómy vodíka, ktoré tvoria jednoduchú väzbu s uhlíkom, ju tvoria pomocou svojho orbitálu:
Zvyšná „čistá“ orbitálna dvojitá väzba atómu kyslíka a molekuly formaldehydu má nasledujúcu štruktúru:
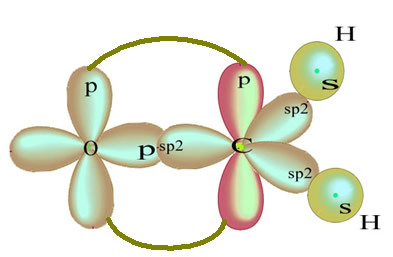
Pokiaľ ide o typ väzieb existujúcich v tejto štruktúre formaldehydu, máme:

Pripojenia: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm
