Objemová analýza alebo odmerka to je a laboratórny postup, pri ktorom použijeme určitý objem a Riešenie v koncentrácia je známe, že určuje koncentráciu iného roztoku. Objem roztoku známej koncentrácie sa určí, keď úplne reaguje s roztokom neznámej koncentrácie, to znamená, že príslušné roztoky musia navzájom reagovať.
Najbežnejšie používané nástroje na meranie daného objemu sú:
- Pipetou

Príklad pipety použitej na meranie objemu
- Byreta

Byreta je dôležité volumetrické meracie zariadenie
Meranie objemu sa vykonáva vyhodnotením výšky takzvaného menisku, čo nie je nič iné ako povrchová oblasť kvapaliny, ktorá má v závislosti od hrúbky nádoby obdĺžnikový alebo kupolovitý tvar (tvar kvapky). Čím je nádoba širšia, tým je meniskus obdĺžnikovejší; čím je nádoba tenšia, tým bude vypuklejšia. Na posúdenie menisku musí byť oko presne vo svojej výške a ako referenčnú oblasť musíme použiť dolnú oblasť, ak je meniskus obdĺžnikový, alebo koniec, ak je vypuklý. Pozrite si znázornenie hodnotenia:
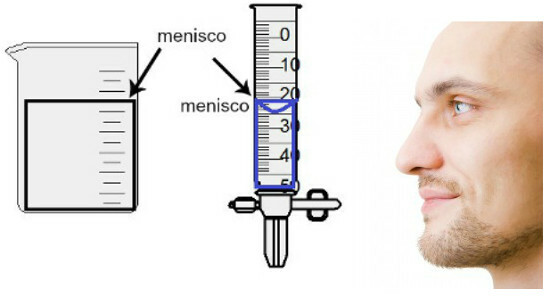
Na posúdenie menisku je dôležité, aby sa vaše oči pozerali smerom k nemu.
Pri objemovej analýze je najpoužívanejším vybavením byreta. Je to preto, lebo metóda zahrnuje chemické reakcie, ktoré sa dajú rýchlo spracovať, a byreta to umožňuje kvapalina sa na svojom hrote uvoľňuje po kvapkách, čo nám umožňuje zabrániť tomu, aby tekutina viac vychádzala kontrolované.
Jedným z najbežnejšie používaných postupov v rámci volumetrie je titrácia. Jedná sa o volumetrickú analýzu, ktorá zahŕňa výskyt reakcie medzi kyselinou a zásadou alebo naopak. Vybavenie potrebné na jeho realizáciu je znázornené na obrázku nižšie:
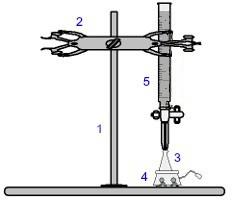
Reprezentácia zariadenia použitého pri titrácii
Čísla modrou farbou znamenajú:
1) Univerzálna podpora;
2) Pazúr (slúži na držanie byrety);
3) Erlenmeyer (dostane roztok neznámej koncentrácie);
4) Magnetické miešadlo (používané na miešanie roztoku prítomného v Erlenmeyerovej banke);
5) Byreta (dostane roztok známej koncentrácie).
Do Erlenmeyerovej banky sa pridá objem roztoku neznámej koncentrácie s indikátorom fenolftaleínu (roztok okamžite zružovie). Do byrety sa vloží určitý objem roztoku známej koncentrácie. Potom sa kyslý roztok z byrety priamo nakvapká do zásaditého roztoku v Erlenmeyerovej banke. Toto kvapkanie trvá, kým bázický roztok nestane bezfarebný, a vtedy ho nazývame bod obratu, čo naznačuje, že všetka báza prítomná v roztoku úplne reagovala s kyselinou.
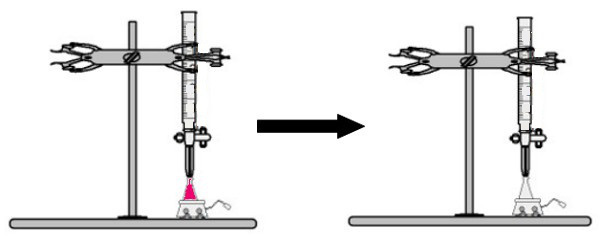
V bode zlomu už roztok nie je ružový a stáva sa bezfarebným
Pozorovanie: Ak je roztokom neznámej koncentrácie kyselina, potom, čo dostane indikátor fenolftaleínu, bude bezfarebný. Bod obratu v titrácii teda bude, keď kyslý roztok zružovie, keď dostane zásaditý roztok z byrety.
Nakoniec na určenie koncentrácie základného roztoku stačí použiť nasledujúcu rovnicu:
Ma.Va = Mb.Vb
Ma = kyslá molarita;
Va = objem kyseliny;
Mb = základná molarita;
Vb = základný objem.
Teraz nasledujte príklad toho, ako sa vykonáva výpočet roztoku s neznámou molaritou.
1.) 30 ml roztoku neznámej bázy sa pridalo do Erlenmeyerovej banky na vykonanie titrácie na stanovenie jej koncentrácie (molarita). Do byrety sa pridalo 50 ml kyslého roztoku s koncentráciou 0,2 mol / l. Po kvapkách kyslého roztoku a až do titrácie bázického roztoku sa pozorovalo, že na titráciu sa použilo 20 ml kyslého roztoku. Určte molaritu použitého základného roztoku.
Údaje o cvičení:
Vb = 30 ml
Mb =?
Ma = 0,2 mol / l
Va = 20 ml
Pretože molarita kyseliny je 0,2 mol / la jej objem je 20 ml, objem použitej bázy je 30 ml, stačí použiť titračný vzorec:
Ma.Va = Mb.Vb
0,2,20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol / l
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm


