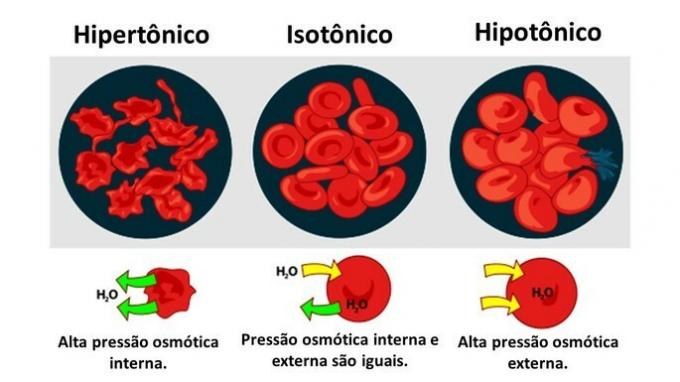
Jedným zo spôsobov, ako sú chemické prvky organizované, sú rodiny, ktoré zodpovedajú vertikálnym sekvenciám periodickej tabuľky.
O 18 stĺpcov tabuľky zoskupiť prvky podľa podobnosti v chemických vlastnostiach.
Usporiadanie chemických prvkov do skupín bolo praktickým spôsobom, ako štruktúrovať rôzne nájdené informácie a prezentovať ich jednoduchým spôsobom.
Na uľahčenie umiestnenia chemického prvku boli rodiny označené v číslach od 1 do 18 takto:
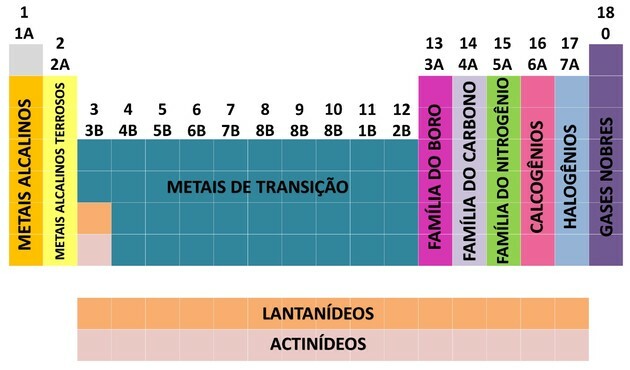
S prispením mnohých vedcov a rôznymi pokusmi o usporiadanie údajov sa vyvinula periodická tabuľka, ktorá ustanovila poriadok na usporiadanie prvkov.
Názvoslovie rodín
- Rodiny v tabuľke boli rozdelené na A (reprezentatívne) a B (prechodné), ktoré boli identifikované podľa písmen a čísel.
- Vy reprezentatívne prvky rodiny 0, 1A, 2A, 3A, 4A, 5A, 6A a 7A zodpovedajú.
- Vy prechodové prvky rodiny 1B, 2B, 3B, 4B, 5B, 6B, 7B a 8B zodpovedajú.
- Stanovením Medzinárodnej únie čistej a aplikovanej chémie (IUPAC) boli rodiny identifikované v skupiny od 1 do 18 rokov.
Periodická tabuľka a elektronická distribúcia
Podobnosti medzi prvkami tej istej rodiny sa vyskytujú, pretože počet valenčných elektrónov atómu v základnom stave je rovnaký pre členov určitej skupiny.
Napríklad:
| Skupina 1 | Elektronická distribúcia |
|---|---|
| 3čítať | 2-1 |
| 11O | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Čs | 2-8-18-18-8-1 |
| 87O | 2-8-18-32-18-8-1 |
Atómy skupiny 1 majú svoje elektróny rozložené na viac ako jednej energetickej úrovni, ale všetky majú valenčný elektrón.
S tým pozorujeme, že výroba elektronická distribúcia atómu v základnom stave nájdeme jeho polohu na periodickej tabuľke.
reprezentatívne prvky
Reprezentatívne prvky vykazujú relatívne menej zložité chemické správanie ako prechodné prvky a tvoria väčšinu látok okolo nás.
Niektoré z reprezentatívnych skupín prvkov majú špeciálne mená, ako je uvedené nižšie:
Skupina |
Rodina | konkrétny názov | Pôvod mena | Prvky | elektronická konfigurácia |
|---|---|---|---|---|---|
| 1 | 1A | alkalické kovy | z latinčiny alkálie, čo znamená „sivá rastlina“. | Li, Na, K, Rb, Cs a Fr | nás1 |
| 2 | 2A | kovy alkalických zemín | Pojem „pozemský“ označuje „existujúci na zemi“. | Be, Mg, Ca, Sr, Ba a Ra | nás2 |
| 13 | 3A | bórová rodina | Názov prvého prvku rodiny. | B, Al, Ga, In, Tl a NH. | nás2np1 |
| 14 | 4A | uhlíková rodina | Názov prvého prvku rodiny. | C, Si, Ge, Sn, Pb a Fl. | nás2np2 |
| 15 | 5A | Rodina dusíka | Názov prvého prvku rodiny. | N, P, As, Sb, Bi a Mc. | nás2np3 |
| 16 | 6A | Chalkogény | z gréckeho khalks, keďže sú to prvky nachádzajúce sa v medených rudách. | O, S, Se, Te, Po a Lv. | nás2np4 |
| 17 | 7A | Halogény | Grécky výraz znamená soľotvorné látky. | F, Cl, Br, I, At a Ts. | nás2np5 |
| 18 | 0 | Ušľachtilé plyny | Uvažovalo sa o tom, že nereaguje s inými látkami. | On, Ne, Ar, Kr, Xe, Re a Og. | 1 s2 (On) alebo my2np6 |
Z tabuľky vidíme, že:
- Prvky uvedené vyššie sú klasifikované ako reprezentatívne, pretože majú najenergetickejší elektrón na s alebo p podúrovni.
- Elektróny sú distribuované na energetických úrovniach a n predstavuje krajnú hladinu atómu v základnom stave.
- Reprezentatívne prvky podľa odporúčania IUPAC patria do skupín alebo rodín 1,2,13,14,15,16,17 a 18.
O vodík klasifikuje sa oddelene od ostatných prvkov. Aj s elektronickou konfiguráciou 1 s1, nie je súčasťou skupiny 1 za prejav jedinečného správania.
prechodové prvky
Prechodové prvky zodpovedajú skupinám 3 až 12. Tento názov dostávajú preto, lebo majú stredné vlastnosti medzi skupinami 1 a 2 a reprezentatívnymi nekovovými prvkami.
Vy prechodné kovy sú definované IUPAC ako:
Prechodový prvok má neúplnú podúrovňu d alebo môže vytvárať katióny s neúplnou podúrovňou d.
Keď je najenergetickejší elektrón atómu základného stavu v neúplnej d podúrovni, charakterizuje sa to ako vonkajší prechod.
Lantanidy a aktinidy sú interné prechodné prvky, pretože majú najmenej jednu neúplnú podúrovňu.
Keď majú prvky elektróny, ktoré vypĺňajú orbitály d alebo f, prejavujú podobné vlastnosti a je možné ich klasifikovať na orbitálne prvky d alebo f. vonkajší alebo vnútorný prechod.
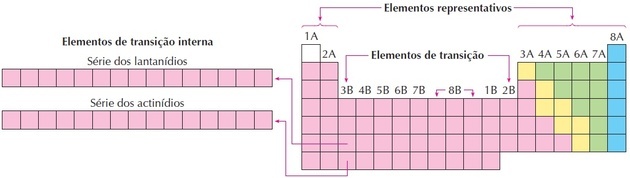
Ako vidíme na obrázku, rodina 8B zodpovedá 3 stĺpcom, ide o skupiny 8, 9 a 10, ktoré boli takto zoskupené, pretože majú podobné vlastnosti.
Hlavné charakteristiky rodín
Nasledujúca tabuľka zobrazuje hlavné vlastnosti skupín v periodickej tabuľke:
| Skupina | Vlastnosti | zložené látky viac bežné |
výskyty |
|---|---|---|---|
| 1 | Pevné a lesklé v okolitých podmienkach. Veľmi reaktívne, mäkké a dobré vodiče elektriny. | Soli, hydroxidy a oxidy |
Reagujte s halogénmi a tvorte soli. |
| 2 | Menej reaktívne a tvrdšie ako skupina 1. Tuhé látky striebra s dobrou vodivosťou. | Soli, hydroxidy a oxidy |
Formujúce soli a oxidy. |
| 3 až 12 | Tvoria komplexy. Sú to pevné kovové látky, tvrdé a krehké, s výnimkou ortuti, ktorá je kvapalinou. | Soli, oxidy a komplexy. Pr.: AgNO3, TiO a [Cr (OH)3(H2O)3] |
V mineráloch vo forme oxidov. |
| 13 | Tuhé látky v okolitých podmienkach, striebro, okrem bóru. | Oxidy Pr.: B2O3 |
V mineráloch vo forme oxidov. |
| 14 | Pevný za okolitých podmienok. | Atómy C a Si sa môžu usporiadať do reťazcov a produkovať obrovské množstvo látok. | V živých organizmoch a vo forme kremičitanov alebo oxidov. |
| 15 | Pevné látky, okrem dusíka, ktorý je za podmienok okolia plynný. | Oxidy a kyseliny Príklad: NIE2 a H3PRACH4 |
Atmosféra, živé organizmy a minerály. |
| 16 | Pevné látky, okrem kyslíka, ktorý je za podmienok okolia plynný. | Sulfidy a oxidy Príklad: ZnS a SiO2 |
Atmosféra, živé organizmy a minerály. |
| 17 | Tvoria dvojatómové molekuly a sú veľmi reaktívne. Sú zlými vodičmi elektriny a tepla. Sú agresívne voči živým bytostiam a životnému prostrediu. | Kyseliny a soli. Príklad: HCl a KBr |
Sú prítomné v látkach organické a minerálne. |
| 18 | Sú veľmi stabilné a nachádzajú sa vo forme plynov. | Ťažko tvoria zložené látky. | Plyny v atmosfére. |
Chemické a fyzikálne vlastnosti odlišujú jednu rodinu od druhej. Ako sme videli, chemické vlastnosti súvisia s elektróny valencie, a prostredníctvom nich atóm interaguje s druhým, je zodpovedný za chemické správanie a chemické väzby tvoril.
Fyzikálne vlastnosti prvkov v rovnakej skupine sa môžu líšiť podľa atómového čísla a hmotnosti.
Cvičenia
Teraz, keď viete niečo viac o rodinách periodických tabuliek, otestujte si svoje vedomosti a uvidíte, čo ste sa naučili.
1) Zvážte nasledujúci výňatok z Periodickej tabuľky.
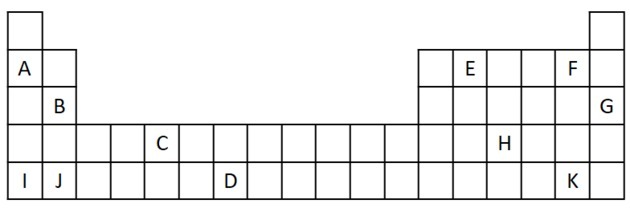
a) Vymenujte dva prvky, ktoré majú dva valenčné elektróny.
b) Označte prvok, ktorý prudko reaguje s vodou za vzniku hydroxidu kovu.
c) Uveďte nereaktívny prvok.
d) Uveďte dva prvky, ktoré sa kombinujú s alkalickými kovmi za vzniku solí.
Odpoveď:
a) B a J
Dva valenčné elektróny zodpovedajú skupine 2, ktorá má konfiguráciu elektrónov ns2 a sú v cvičení zastúpení B a J.
b) A, B, I alebo J.
A a I predstavujú prvky rodiny 1; B a J sú z rodiny 2. Ako sme videli v tabuľke vlastností, prvky skupiny 1 a 2 sú veľmi reaktívne a môžu vytvárať hydroxidy, ako v uvedených príkladoch: KOH a Mg (OH)2.
c) G
Ušľachtilé plyny sú veľmi stabilné, a preto nie sú príliš reaktívne. Písmeno G sa vkladá do tabuľky ako prvok tejto rodiny.
d) F a K.
Halogény reagujú s alkalickými kovmi za vzniku solí. Najbežnejším príkladom je kuchynská soľ NaCl.
2) Nasledujúci obrázok zobrazuje tri chemické prvky, zľava doprava, lítium, sodík a draslík.

Vyberte možnosť, ktorá správne dokončí každé z nasledujúcich vyhlásení.
1.1) „Môžeme povedať, že lítium, sodík a draslík…
(A)... patrí do rovnakého obdobia. “
(B)... má rovnaké atómové číslo. “
(C)... patrí do rovnakej skupiny. “
(D)... má rovnaké hmotnostné číslo. “
1.2) „Prvky lítium, sodík a draslík ...
(A)... má veľmi podobné chemické vlastnosti. “
(B)... má veľmi odlišné chemické vlastnosti. “
(C)... sú nekovy. “
(D)... reaguje s vodou za vzniku kyslých roztokov. “
Odpovede:
1.1) (C) patrí do rovnakej skupiny.
1.2) (A) má veľmi podobné chemické vlastnosti.
Tieto informácie môžeme získať nahliadnutím do periodickej tabuľky alebo elektronickou distribúciou prvkov lítium, sodík a draslík. Uvidíme, že všetky tri majú vo valenčnom plášti elektrón a pretože sú súčasťou tej istej skupiny, chemické vlastnosti sú si veľmi podobné.
3) Zvážte nasledujúcu tabuľku, kde sú znázornené atómové čísla a elektronické distribúcie niektorých chemických prvkov.
| Element | chemický symbol | atómové číslo | Elektronická distribúcia |
|---|---|---|---|
| Lítium | čítať | 3 | 2,1 |
| Berýlium | byť | 4 | 2,2 |
| Fluór | F | 9 | 2,7 |
| neón | Hu | 10 | 2,8 |
| chlór | Cl | 17 | 2,8,7 |
| argón | Vzduch | 18 | 2,8,8 |
| Draslík | K | 19 | 2,8,8,1 |
| Vápnik | Tu | 20 | 2,8,8,2 |
Uveďte skupinu každého prvku.
Odpoveď:
Lítium a draslík: skupina 1. (Majú elektrón vo valenčnom plášti).
Berýlium a vápnik: skupina 2. (Vo valenčnom plášti majú dva elektróny).
Fluór a chlór: skupina 17. (Vo valenčnej škrupine majú sedem elektrónov).
Neón a argón: skupina 18. (Vo valenčnej škrupine majú osem elektrónov).
Skontrolujte otázky týkajúce sa prijímacích skúšok s komentovaným rozlíšením v Cvičenia z periodickej tabuľky a nezverejnené otázky týkajúce sa tejto témy v Cvičenia z organizácie periodickej tabuľky.