Tretí zákon termodynamiky sa zaoberá správaním hmoty s entropiou blížiacou sa k nule.
Podľa tohto zákona, kedykoľvek je systém v termodynamickej rovnováhe, jeho entropia sa blíži k nule.
Druhý zákon termodynamiky sa týka entropie. Následne sa tretí zákon javí ako a pokus o stanovenie absolútneho referenčného bodu, ktorý určuje entropiu.
Walther Nernst (1864-1941) bol fyzik, ktorý sa zaoberal princípmi, ktoré tvorili základ pre tretí zákon termodynamiky.
Podľa Nernsta by entropia mala tendenciu mať minimálnu hodnotu, ak by sa teplota čistej látky rovnala alebo blížila k absolútnej nule.
Preto Nernst navrhol nasledujúci vzorec, ktorý ukazuje, že zmeny entropie (ΔS) a teploty (T) majú tendenciu k minimálnym hodnotám, to znamená 0:
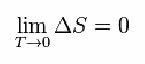
Čo je to však Entropy?
Entropia je to spôsob, ako sa molekuly organizujú v systéme. Táto organizácia sa premieta do poruchy, nie však v zmysle zmätku, ale v zmysle pohybu a miešania molekúl.
Čím viac molekúl sa môže pohybovať, tým sú neusporiadanejšie, tým majú väčšiu entropiu.
Nernst spočiatku naznačoval, že entropia, ktorú navrhol, bude možná iba na dokonalých kryštáloch.
Nakoniec dospel k záveru, že teplota rovná sa absolútnej nule neexistuje, čo z tretieho zákona robí kontroverzný zákon.
Pre mnohých fyzikov teda nejde o zákon, ale o pravidlo.
Po toľkých rokoch (od roku 1912) sa vedci snažia získať túto teplotu alebo teploty, ktoré sa čoraz viac blížia k absolútnej nule. Zistili teda, že je to možné iba v plynoch, pričom sa zbavili akejkoľvek látky v tuhom alebo kvapalnom stave.
Prečítajte si tiež:
- Nulový zákon termodynamiky
- Prvý zákon termodynamiky
- Druhý zákon termodynamiky
- Cvičenie z termodynamiky