Text Titrácia ukázal, ako sa vykonáva táto technika volumetrickej analýzy, ktorej hlavným cieľom je identifikujte koncentráciu roztoku jeho reakciou s iným roztokom známej koncentrácie.
Teraz uvidíme, ako pomocou údajov získaných pri titrácii dospieť k požadovanej koncentrácii, ktorou môže byť kyselina alebo zásada v roztoku. V zásade existujú tri kroky:
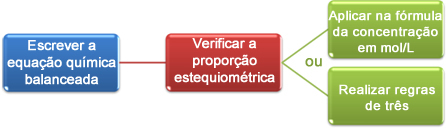
Pozrime sa na príklad:
Povedzme, že chemik mal roztok kyseliny octovej (ocot (CH3COOH(tu))) a chcel zistiť jeho koncentráciu v mol / L. Potom vložil 20,0 ml octu (titrovaného) do Erlenmeyerovej banky a pridal indikátor fenolftaleínu. Potom naplnil 100 ml byrety hydroxidom sodným (NaOH) so známou koncentráciou (titrant) rovnou 1,0 mol / l. Nakoniec chemik vykonal titráciu a všimol si, že zmena farby (bod obratu - keď zastavil titráciu) nastala, keď sa spotrebovalo 24 ml NaOH.

Na základe tohto experimentu získal nasledujúce údaje:
MCH3COOH= ?
V.CH3COOH = 20 ml = 0,02 l
MNaOH = 24 ml = 0,024 l
V.NaOH = 1,0 mol / l
Kde M = koncentrácia v mol / L a V = objem v L.
Aby sme zistili koncentráciu kyseliny octovej, musíme najskôr vedieť, ako napísať chemickú rovnicu, ktorá predstavuje správne vyváženú neutralizačnú reakciu, ku ktorej došlo. V tomto prípade je reakcia nasledovná:
1 CH3COOH(tu) + 1 NaOH(tu) → 1 NaC2H3O2 (aq) + 1 hodina2O(ℓ)
V tejto časti je dôležité vidieť stechiometrický pomer, pri ktorom reagujú reaktanty. Pamätajte, že pomer je 1: 1, to znamená, že na každý mól kyseliny octovej je potrebný 1 mól hydroxidu sodného.
Teraz môžeme vo výpočtoch pokračovať dvoma spôsobmi:
(1) Prostredníctvom vzorca: M1. V.1 = M.2. V.2
Pretože stechiometrický pomer je 1: 1, musíme: čCH3COOH = nNaOH .
Byť M = n / V → n = M. V.. Dostávame sa teda k vyššie uvedenému zoznamu, ktorý môže byť v tomto prípade napísaný takto: MCH3COOH. CH3COOH = M.NaOH. V.NaOH
Stačí teda nahradiť hodnoty tohto vzorca:
MCH3COOH. V. CH3COOH = M.NaOH. V.NaOH
MCH3COOH. 0,02 l = 1,0 mol / l. 0,024 l
MCH3COOH = 0,024 mol
0,02 l
MCH3COOH = 1,2 mol / l
Preto bola počiatočná koncentrácia roztoku kyseliny octovej, náš názov, 1,2 mol / l.
Dôležitá poznámka: Keby stechiometrický pomer nebol 1: 1, stačilo by sa koncentrácia látok v mol / L (M) vynásobiť ich príslušnými koeficientmi. Napríklad, ak by bol pomer 1: 2, mali by sme toto:
M1. V.1 = 2. M2. V.2
Ale tu je ďalší spôsob, ako vykonať tieto výpočty:
(2) Prostredníctvom pravidiel troch:
1 CH3COOH(tu) + 1 NaOH(tu) → 1 CH3COONa(tu) + 1 hodina2O(ℓ)
1 mol 1 mol 1 mol 1 mol
1. 60 g 1. 40 g 1. 82 g 1. 18 g
Tieto hmotnosti sú vypočítané molekulové hmotnosti pre každú látku.
* S vedomím, že spotrebovaný objem roztoku NaOH 1,0 mol / L(tu) bolo 24 ml, môžeme najskôr zistiť množstvo hmoty (mol) NaOH, ktoré reagovalo:
1 mol NaOH → 1,0 L
1 mol NaOH 1000 ml
x 24 ml
x = 0,024 mol NaOH
* Pretože pomer je 1: 1, malo by byť množstvo hmoty (mol) kyseliny octovej rovnaké ako NaOH: 0,024 mol.
Pozorovanie: Keby bol stechiometrický pomer iný, potom by sme to v tejto časti zohľadnili. Napríklad, ak by to bolo 1: 3 a množstvo látky jedného chemického reaktívneho druhu by bolo rovné 0,024 mol, potom by to bolo pre druhú látku trojnásobné: 0,072.
* Teraz počítame:
20 ml octu, 0,024 mol kyseliny octovej
1000 ml octu a
y = 1,2 mol
To znamená, že existuje 1,2 mol / L, čo je rovnaká hodnota, akú sme dostali pri predchádzajúcej metóde.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/calculos-envolvidos-na-titulacao.htm
