Organické zlúčeniny sú molekulárne, to znamená, že ich atómy navzájom nesú kovalentné väzby. Keď analyzujeme väzby medzi uhlíkmi, ktoré môžu byť jednoduché, dvojité alebo trojité, zistíme, že sú nepolárne väzby, pretože medzi atómami nie je rozdiel v elektronegativite, pretože k nim patria element.
Ďalej, pretože vodík a uhlík majú veľmi malý rozdiel elektronegativity, väzby medzi nimi sú tiež nepolárne.
Nepolárne pripojenia:
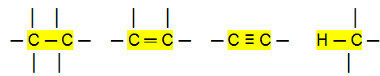
S tým môžeme dospieť k záveru, že Uhľovodíky (organické zlúčeniny, ktoré majú iba atómy uhlíka a vodíka) sú nepolárne molekuly. V týchto zlúčeninách je intermolekulárna interakcia typu indukovaného dipólu, ktorý je najslabší, aký existuje.
Pretože sú slabé, tieto interakcie sa dajú ľahko prerušiť. Z tohto dôvodu teploty varu a topenia uhľovodíkov sú nižšie ako teploty ostatných funkcií.

Pri porovnaní uhľovodíkov teploty varu sa zvyšujú, pretože sa zvyšuje aj molárna hmotnosť.
Napríklad etán aj bután sú oba alkány. Pozri body varu každého experimentálne určeného:
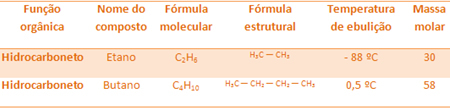
Upozorňujeme, že teplota varu butánu je oveľa vyššia ako teplota varu etánu, pretože jeho molárna hmotnosť je tiež vyššia.
Keď teraz porovnáme uhľovodíky, ktoré majú rovnakú molárnu hmotnosť (sú to izoméry), ale ktoré majú rôzne typy uhlíkových reťazcov, uvedomíme si, že čím väčší je počet vetiev, tým nižšia je teplota varu, pretože štruktúra molekuly sa stáva kompaktnejšou, to znamená, že sa zmenšuje jej povrch.
Všetky alkány uvedené nižšie majú rovnaký molekulový vzorec C5H12, ale ich teploty varu sú rôzne:
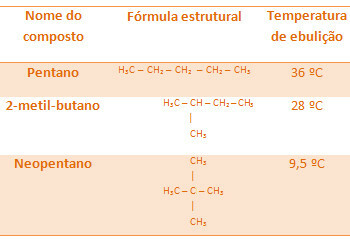
Upozorňujeme, že teplota varu neopentánu je najnižšia, pretože má viac vetiev.
Môžeme uvažovať, že ďalšie organické funkcie sú odvodené od uhľovodíkov nahradením jedného alebo viacerých vodíkov atómami alebo skupinami atómov iných prvkov. Ostatné organické funkcie majú spravidla kyslík alebo dusík, ktoré sú viac elektronegatívnymi prvkami ako uhlík. Silnejšie priťahujú pár elektrónov zdieľaných s uhlíkom, a preto robia molekulu polárnou:
Polárne spojenia:
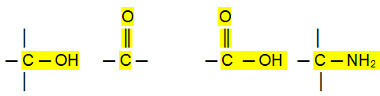
Aldehydy, ketóny a organické halogenidy majú vyššie teploty varu ako uhľovodíky, pretože ich intermolekulárnou interakciou je permanentný dipól, ktorý je silnejší ako u indukovaný dipól.
Alkoholy, karboxylové kyseliny a amíny majú naopak ešte vyššie teploty varu, pretože uskutočňujú vodíkové väzby, najintenzívnejší typ intermolekulárnej interakcie.
V zlúčeninách všetkých týchto funkcií platí to isté, čo sme videli pre uhľovodíky:

Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm

