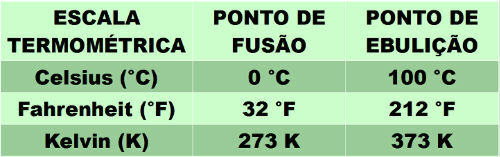
Daltonov zákon hovorí, že parciálny tlak každého plynu v zmesi plynov sa rovná tlaku, ktorý by vyvíjal pri obsadení objemu zmesi pri rovnakej teplote. Preto je celkový tlak plynnej zmesi súčtom parciálnych tlakov každého plynu, ktorý ju tvorí.
Uvažujme o dvoch druhoch plynov, A a B. Každý z nich zaberá rovnaký objem V a má rovnakú teplotu T. Ak použijeme Clapeyronovu rovnicu na dva plyny A a B, máme:
PTHE .V = nTHE .R .T a strB .V = nB .R .T
Ako je znázornené na obrázku vyššie, ak zmiešame tieto dva plyny, počet mólov plynov v zmesi (čm) sa stane:
čm= nTHE+ nB
Kde:

Ale nm = (Pm.V) / R. T; takže máme:

Zjednodušenie vyššie uvedeného výrazu umožňuje:
Pm= strTHE+ strB (Daltonov zákon)
Rovnaké úvahy môžeme uplatniť aj na plyny rôznych objemov a teplôt. Pozrime sa na obrázok nižšie, na ktorom majú dva balóny spojené trubičkou zanedbateľného objemu kontaktný kohútik. Tieto balóny majú dva plyny A a B, ktorých teploty a objemy sa navzájom líšia. Z obrázku vidíme, že faucet je uzavretý, preto:
Teraz neprestávajte... Po reklame je toho viac;)
PTHE .V = nTHE .R .T a strB .V = nB .R .T

Neskôr, ak otvoríme faucet, uvidíme, že sa plyny zmiešajú, ako je to znázornené na obrázku nižšie:

Pre túto zmes máme nasledujúce vzťahy:
V.m= VTHE+ VB
PTHE .V = nTHE .R .T
PB .V = nB .R .T
Takže máme, že konečný vzťah tejto zmesi možno rozšíriť na zmes č plyny. Takto:


Autor: Domitiano Marques
Vyštudoval fyziku
Brazílsky školský tím
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
SILVA, Domitiano Correa Marques da. „Plynová zmes“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/fisica/mistura-gasosa.htm. Sprístupnené 27. júna 2021.