Chloridy sú také iónové zlúčeniny, ktoré obsahujú anión Cℓ-1.
Chlór je z rodiny 17 alebo 7A, jeho atómové číslo je rovné 17 a má 7 elektrónov vo valenčnom obale (najvzdialenejší elektrónový obal atómu). Podľa pravidlo okteta, aby bol stabilný, musí mať v tejto poslednej škrupine 8 elektrónov, a preto musí prijať ešte jeden elektrón. Keď sa to stane, to znamená, že keď prijme elektrón, všeobecne z iónovej väzby s kovom, vznikne â.chlorid anión (Cℓ-1), kov, ktorý sa vzdal elektrónu, sa stane katiónom a vytvorená látka je iónová.
Chloridy sú soli odvodené z reakcie zásady s kyselinou chlorovodíkovou (HC3(tu)). Báza poskytuje katión a kyselina chlorovodíková poskytuje chloridový ión:
Generická zásada + kyselina chlorovodíková → Chlorid + voda
ÇOH + HCℓ → ÇCℓ + H2O
Chloridy sú klasifikované ako anorganické soli, pretože vo vodnom prostredí uvoľňujú iný katión ako H+ a uvoľní sa chloridový anión, nie hydroxyl (OH-).
Nomenklatúra chloridov sa vždy riadi týmto pravidlom: Chlorid +de + (názov prvku spojeného s chlórom).
O tvoje vzorce sa tvoria výmena iónových nábojov za indexy (číslo, ktoré je v pravom dolnom rohu symbolu prvku, udáva počet prítomných atómov prvku, ktoré vytvárajú väzby).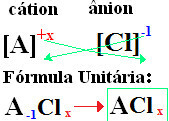
ak index je "1", nemusíte ho písať do vzorca, ako je uvedené nižšie:
O+1 Cℓ-1 → O1Cℓ1 → OC3: chlorid sodný;
K+1 Cℓ-1 → K.C3: chlorid draselný;
Tu+2 Cℓ-1→CaCℓ2: chlorid vápenatý;
Teraz neprestávajte... Po reklame je toho viac;)
Ba+2 Cℓ-1→ Btu2: chlorid bárnatý;
Aℓ+3 Cℓ-1→ACℓ3: chlorid hlinitý.
Ako je však vysvetlené v texte „Iónové látky skupiny: chlorid, uhličitan, dusičnan a síran„Rovnako ako všetky iónové látky, ani chloridy nemajú jednotné vzorce izolované v prírode, pretože ich ióny sa navzájom priťahujú a vytvárajú kryštalické mriežky.
Hlavným príkladom chloridu, ktorý máme v každodennom živote, je chlorid sodný, NaCℓ, kuchynská soľ. Pozrite sa na iónovú väzbu, ktorá vedie k jej tvorbe (v ktorej sodík dodáva elektrón chlóru) a pod kryštálovou mriežkou tejto soli:
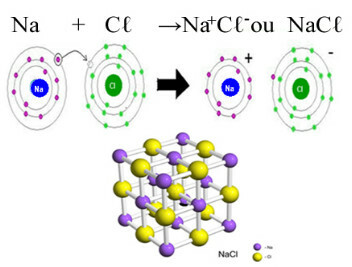
V kryštalickej mriežke chloridu sodného každý anión Cℓ- je obklopený 6 katiónmi Na+ a naopak, takže koordinačné číslo tejto kryštálovej mriežky je 6.
Všetky chloridy sú pevné látky v okolitých podmienkach a celkom rozpustné vo vode, patria medzi najbežnejšie soli nachádzajúce sa v našom každodennom živote, berúc do úvahy niekoľko z nich sú prítomné rozpustené v minerálnych vodách, pitnej vode, vode z vodovodu, riekach, moriach iné. Medzi výnimkami, ktoré sú vo vode nerozpustné chloridy, patrí chlorid strieborný (AgCℓ - znázornený na nasledujúcom obrázku), z zlúčeniny olova, medi a ortuti.

Vo vode nerozpustný chlorid strieborný *
Ióny Cℓ-1 z chloridov, ktoré prijímame, hlavne v soľ, ryby a mäso, sú dôležité pre niektoré funkcie ľudského tela, pretože sú hlavným extracelulárnym aniónom, sú prítomné v šťave žalúdočné, regulujú telesné tekutiny, ako je distribúcia vody v tele, a udržiavajú plazmatický osmotický tlak a neutralitu elektrický.
Jeho nedostatok môže spôsobiť úzkosť, hnačky a problémy s krvným obehom. Jeho nadbytok sa vylučuje močom (v priemere každý človek vylúči asi 4 g chloridu denne), potom a stolicou.
*Kredit na obrázok: Autor: Danny S. / Obrázok extrahovaný z: Wikimedia Commons
Autor: Jennifer Fogaça
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. "Chloridy"; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/cloretos.htm. Prístup k 28. júnu 2021.
Chémia

Každodenné soli, uhličitan vápenatý, chlorid sodný, fluorid sodný, dusičnan draselný, dusičnan sodný sodík, uhličitan sodný, hydrogenuhličitan sodný, hydrogenuhličitan sodný, siričitan sodný, soľka, sóda.

