Každý článok je zariadenie, v ktorom dochádza k spontánnej oxidačno-redukčnej reakcii, pri ktorej sa generuje elektrický prúd, ktorý sa zase používa na uvedenie niektorých zariadení do činnosti.
Tieto zariadenia dostali svoje meno, pretože prvú batériu, ktorá má byť vytvorená, vynašiel Alessandro Ešte v roku 1800 ho tvorili zinkové a medené disky oddelené vsiaknutou bavlnou soľanka. Táto súprava bola umiestnená striedavo, jedna na druhej, hromadí disky a tvoria veľký stĺp. Aké bolo batéria diskov, sa začali nazývať týmto menom.

Batérie sú vždy tvorené dvoma elektródami a elektrolytom. Kladná elektróda sa nazýva a katóda a tu reaguje reakcia zníženie. Záporná elektróda je anóda a tu reaguje reakcia oxidácia. Tiež sa nazýva elektrolyt soľný most a je roztokom vedúcim ióny.
Informácie o tom, ako generuje elektrický prúd, nájdete v prípade jednej z prvých batérií, Daniellina hromada, v ktorom bola nádoba s roztokom síranu meďnatého (CuSO4 (aq)) a ponorený do tohto roztoku bol medenou doskou. V ďalšej samostatnej nádobe bol roztok síranu zinočnatého (ZnSO
4 (aq)) a máčanú zinkovú dosku. Oba roztoky boli spojené soľným mostíkom, ktorým bola sklenená trubica s roztokom síranu draselného (K.2IBA4 (aq)) so sklenenou vlnou na koncoch. Nakoniec boli dve platne vzájomne prepojené externým obvodom so žiarovkou, ktorej osvetlenie by naznačovalo prechod elektrického prúdu: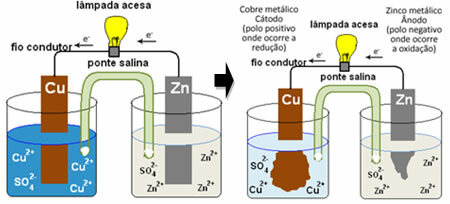
Stáva sa, že zinok má väčšiu tendenciu oxidovať, to znamená stratiť elektróny, takže kovový zinok čepele funguje ako záporná elektróda, anóda, kde dochádza k oxidácii: Zns ↔ Zn2+(tu) + 2 a-. Elektróny stratené zinkom sú prenášané vonkajším obvodom na meď a vytvárajú elektrický prúd, ktorý rozsvieti žiarovku. Ióny medi v roztoku prijímajú elektróny (redukujú sa) a transformujú sa na kovovú meď, ktorá sa ukladá na medenom plechu. To znamená, že ide o kladnú elektródu, katódu, kde dochádza k redukcii: Ass2+(tu) + 2 a- ↔ zadok(s).
Teraz neprestávajte... Po reklame je toho viac;)
Dnešné batérie majú rovnaký princíp činnosti, pri ktorom jeden kov daruje elektróny druhému prostredníctvom vodivého roztoku a vytvára sa elektrický prúd. Rozdiel je v tom, že batérie, ktoré sa dnes používajú, sú suché, pretože nepoužívajú tekutý roztok ako elektrolyt, ako sa to vyskytuje v Daniellových batériách.
V súčasnosti existuje veľké množstvo komerčne dostupných batérií. Medzi nimi najbežnejšie sú kyslé bunky (z Leclanché) aalkalické batérie.
Oba majú zinok ako zápornú elektródu; na druhej strane ako kladný pól je v strede hromady nainštalovaný grafitový prúžok obklopený oxidom manganičitým (MnO2), práškové uhlie (C) a vlhká pasta. Rozdiel je v tom, že na vlhkej paste sa v hromade kyselín používa chlorid amónny (NH).4Cl) a chlorid zinočnatý (ZnCl2) - kyslé soli - okrem vody (H2O). V alkalickej batérii sa používa hydroxid draselný (KOH), ktorý je zásadou.

Batérie Leclanché sú najvhodnejšie pre vybavenie, ktoré vyžaduje ľahké a neustále vybíjanie, ako napríklad diaľkové ovládanie, nástenné hodiny, prenosné rádio a hračky. Alkalické batérie majú naopak o 50 až 100% viac energie ako bežná batéria rovnakej veľkosti, čo sa odporúča pre zariadenia, ktoré vyžadujú rýchlejšie a intenzívnejšie sťahovanie, ako sú rádiá, prehrávače CD / DVD, prenosné MP3, baterky, digitálne fotoaparáty atď.

Zistite viac o tom, čo sa elektrolyty a elektródy používajú v týchto a ďalších typoch batérií. pokiaľ ide o to, aké typy zariadení sa odporúčajú najviac, prečítajte si viac súvisiacich článkov nižšie.
Autor: Jennifer Fogaça
Vyštudoval chémiu


