Atómové číslo, symbolizované písmenom Z, zodpovedá množstvu protónov existujúcich v jadre atómu daného chemického prvku. Napríklad atómové číslo vodíka je 1, čo znamená, že má v atómovom jadre iba 1 protón.
Atómové číslo sa zvyčajne zobrazuje vedľa dolného indexu chemického prvku (v dolnom rohu) vľavo. Príklad: 1H.
V základnom stave sa atómové číslo rovná počtu elektrónov, pretože v tomto stave je prvok neutrálny, preto sa množstvo kladných nábojov (protónov) musí rovnať množstvu záporných nábojov (elektrónov) atóm.
Atómové číslo je dôležité, pretože je to on, kto určuje hlavné charakteristiky a vlastnosti prvku, ako aj jeho správanie a umiestnenie v periodickej tabuľke. Prvky sú uvedené v periodickej tabuľke vo vzostupnom poradí podľa atómového čísla, ktoré sa zvyčajne zobrazuje nad prvkom, ako je uvedené nižšie. Všimnite si, že prvým prvkom je vodík, H (Z = 1), za ktorým nasleduje hélium, He (Z = 2), potom príde lítium, Li (Z = 3) atď.
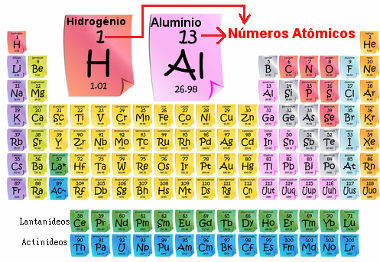
Atómový počet prvkov v periodickej tabuľke
Chemický prvok môžeme dokonca pojať ako bytie
„Množina atómov, ktoré majú rovnaké atómové číslo“. Ak teda hovoríme napríklad o chemickom prvku kyslík, hovoríme o atómoch s atómovým číslom 8. Ďalej máme atómy chemických prvkov z periód 1 a 2 periodickej tabuľky vo vzostupnom poradí podľa atómového čísla:
Chemické prvky z období 1 a 2 periodickej tabuľky vo vzostupnom poradí podľa atómového čísla
Atómové čísla pôvodne definoval anglický fyzik Henry Gwyn Jeffreys Moseley (1887-1915) a pri pokusoch bombardovania rôznych prvkov chemici s röntgenovými lúčmi pozoroval, že druhá odmocnina frekvencie röntgenových lúčov produkovaných emisiou atómového jadra bola priamo úmerná atómovému číslu prvku v tabuľke. Periodické. Týmto dospel k záveru, že atómové číslo súviselo s vlastnosťami atómov, pretože predstavovalo počet kladných nábojov v jadre každého atómu.
Chemické väzby neovplyvňujú atómový počet atómov, pretože zahŕňajú iba elektróny, ktoré sú v elektrosfére. Jadrové reakcie však zahŕňajú atómové jadro, a preto je zahrnuté aj atómové číslo.
Napríklad keď sú častice (hlavne mierne neutróny) bombardované na ťažké, nestabilné atómové jadro, toto jadro je rozbité a vedie k vzniku dvoch menších atómových jadier, to znamená, že s menším počtom protónov a neutrónov uvoľňuje kolosálne množstvo energie.
Jadrová fúzia je na druhej strane opačným procesom, je to vtedy, keď sa spoja dve malé a ľahké jadrá, ktoré vytvárajú väčšie a stabilnejšie jadro a uvoľňujú ešte väčšie množstvo energie.
Kedykoľvek teda dôjde k týmto jadrovým reakciám, vzniknú nové chemické prvky, pretože atómové čísla počiatočných prvkov sa líšia od atómových čísel konečných prvkov. Napríklad nižšie uvidíte, že štiepenie uránu-235 s atómovým číslom 92 vedie k vzniku bária (Z = 56), kryptónu (Z = 36) a troch neutrónov:

Reakcia jadrového štiepenia uránu-235
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-atomico.htm

