Podľa modelu orbitálov vytvoreného Linusom Paulingom v roku 1960 kovalentná väzba, ktorá tvorí Molekuly vznikajú fúziou alebo vzájomným prenikaním neúplných obežných dráh prvkov zapojených do Odkaz. Preto sa dospelo k záveru, že ak má prvok neúplný orbitál (iba s jedným elektrónom), môže vytvoriť iba kovalentnú väzbu. Ak má dva neúplné orbitály, môže uskutočniť maximálne dve spojenia a tak ďalej.
Pozrime sa však na atómové orbitály prvku uhlíka, ktorého atómové číslo sa rovná 6 (Z = 6):
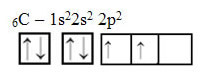
Upozorňujeme, že má dva neúplné orbitaly, takže by mal vykonať iba maximálne dve väzby. To sa mu však nestalo. Ako mnohí vedia, uhlík vytvára štyri väzby (je štvormocný), takže tento model orbitalov nevysvetľuje prípad uhlíka.
Na ukončenie tejto bezvýchodiskovej situácie bola vytvorená nová teória, ktorá túto otázku lepšie vysvetľuje: Teória hybridizácie.

To znamená, že hybridizácia je „zmesou“ čistých orbitálov.
Pre uhlík existujú tri typy hybridizácie, ktoré sú: sp3, sp2 a sp.
Aby sme pochopili, ako prebieha hybridizácia, pozrime sa na prvý typ hybridizácie uhlíka, typ sp.3:
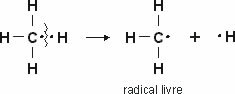
Tento typ hybridizácie sa vyskytuje v molekule metánu (CH4). Všimnite si, že medzi uhlíkom, ktorý je ústredným prvkom, a štyrmi vodíkmi sú štyri identické kovalentné väzby. Takže uvidíte, čo je nekompletný vodíkový orbitál:
Teraz neprestávajte... Po reklame je toho viac;)
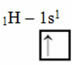
Pretože každý vodík má neúplný orbitál typu s, je potrebné prijať ešte jeden elektrón, to znamená, že každý vytvára iba jednu kovalentnú väzbu s uhlíkom. Preto uhlík musí mať štyri neúplné orbity. Ako sa to stalo? Hybridizáciou.
Keď elektrón z obežnej dráhy 2s absorbuje energiu, prechádza do prázdnej obežnej dráhy 2p. Hovoríme teda, že tento skok elektrónu z 2s na 2p podúrovňu je „propagáciou“ elektrónu. Týmto spôsobom uhlík zostáva v excitovanom alebo aktivovanom stave, pričom sú k dispozícii štyri hybridizované orbitaly na uskutočnenie kovalentných väzieb:
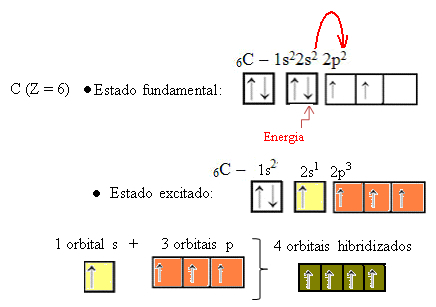
Upozorňujeme, že vytvorené hybridné orbitály sú navzájom rovnocenné, ale líšia sa od pôvodných čistých orbitálov.
Týmto spôsobom dôjde k väzbe medzi orbitálom každého zo štyroch atómov vodíka s týmito štyrmi hybridizovanými uhlíkovými orbitálmi:
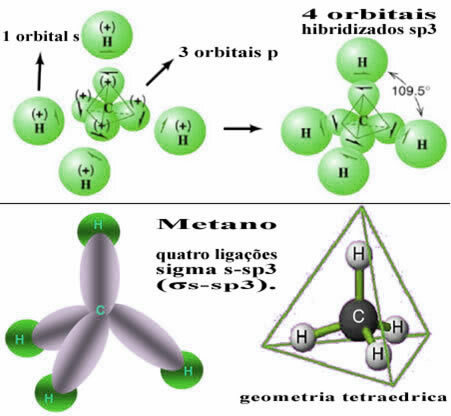
Ako je vidieť vyššie, molekula metánu má pravidelnú štvorstennú štruktúru so štyrmi elektrónovými mrakmi v každom vrchole a susednými uhlami 109 ° 28 ’. Pretože väzba bola vytvorená medzi s orbitálom každého vodíka a hybridizovaným sp orbitálom3 pre každé spojenie potom máme, že sú štyri odkazy sigma s-sp3 (σs-sp3).
Autor: Jennifer Fogaça
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Hybridizácia typu Sp3“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm. Prístup k 28. júnu 2021.