sa definuje ako hybridizácia spojenie neúplných atómových orbitálov. Orbitál je klasifikovaný ako neúplný, ak má iba jeden elektrón v jeho vnútri namiesto dvoch. Pozrite si znázornenie neúplnej a úplnej obežnej dráhy:

Na obrázku A máme úplnú obežnú dráhu; na obrázku B neúplná orbitálna dráha.
Hybridizácia je prirodzený jav, ktorý sa vyskytuje u niektorých chemických prvkov, ako je fosfor, síra, uhlík atď. Hybridizácia uhlíka umožňuje, aby atómy tohto prvku boli schopné vytvárať štyri chemické väzby, to znamená, že uhlík vytvorí štyri väzby až po tom, čo podstúpi fenomén hybridizácie.
Prečo sa však uhlík hybridizuje a vytvára štyri väzby? Aby sme pochopili tento jav, musíme poznať elektronickú distribúciu tohto prvku:
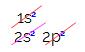
Pri elektronickej distribúcii uhlíka vidíme, že podúroveň 1s je úplná (s dvoma elektrónmi), 2s je kompletný (s dvoma elektrónmi) a podúroveň 2p je neúplná (podúroveň p podporuje šesť elektrónov, ale existuje iba dva). Distribuovaním 2p elektrónov reprezentatívnym spôsobom musíme:
Teraz neprestávajte... Po reklame je toho viac;)
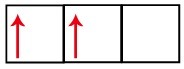
Podúroveň p má tri orbitaly - v prípade uhlíka sú dva z nich neúplné a jeden prázdny. Z tohto dôvodu by tento prvok mal vykonávať iba dva odkazy, pretože počet neúplných orbitálov vždy určuje počet odkazov.
Pri príjme energie z vonkajšieho prostredia sú však elektróny prítomné v uhlíku excitované. Jeden z elektrónov prítomných na podúrovni 2s sa teda presunie na obežnú dráhu podúrovne p, ktorá je prázdna:
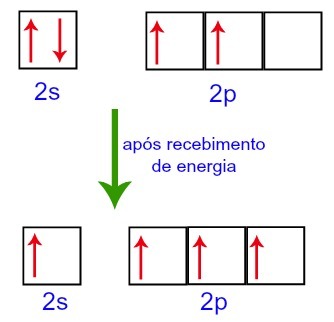
Uhlíkové orbitály pred a po prijatí energie z vonkajšieho prostredia
Uhlíku teda na druhej úrovni zostávajú štyri neúplné orbitaly. Potom sa orbitál podúrovne 2s spojí s tromi p orbitálmi, čo konfiguruje jav hybridizácia.
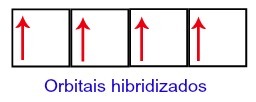
Uhlíkové orbitály po hybridizácii
Podľa mňa. Diogo Lopes Dias
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
DNI, Diogo Lopes. „Hybridizácia uhlíka“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm. Prístup k 28. júnu 2021.


