Keď hovoríme o pH, označujeme hydrogénny potenciál roztoku, to znamená množstvo hydróniových katiónov (H+ alebo H3O+), ktoré sú dispergované v rozpúšťadle roztoku.
Hydróniové katióny sú dobre známe z dôvodu definície navrhnutej vedcom Arhenius pre kyselinu. Tento vedec to tvrdí kyselina je schopná každá látka ionizovať a vo vodnom prostredí produkujú ióny hydrónia.
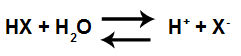
Rovnica kyslej ionizácie
skratka pH slúži ako referencia na stanovenie úrovne kyslosti média. Chemici však už dlho tiež používajú pH ako odkaz na určenie, okrem kyslosti, či je médium zásadité alebo neutrálne.
Je to možné, pretože chemici si dnes uvedomujú, že voda prechádza samoionizáciou, to znamená, že produkuje hydrónium (H+) a hydroxidy (OH.)-). Vodný roztok teda nikdy nemá iba hydrónium alebo hydroxid, ale oba, ako vidíme z nasledujúcej rovnice:

Rovnica autoionizácie vody
Hodnoty použité ako referencia pre pH
Hodnoty použité pre pH sa vzťahuje na ionizačnú konštantu (Kw) vody pri teplote 25 ° COC, čo sa rovná 10-14. Pri tejto teplote sú koncentrácie hydróniových a hydroxidových iónov produkovaných vodou úplne rovnaké, to znamená 10
-7 mol / l.[H+] = [OH-]= 10-7
Z tohto odkazu sú hodnoty použité pre pH v rozmedzí od 0 do 14.
Vzorce na výpočet pH
a) Výpočet z koncentrácie hydróniových katiónov v mol / l
Výpočet hodnoty pH je možné vykonať priamo, pokiaľ poznáme koncentráciu hydrónia ([H+]). Pozri:
pH = -log [H+]
alebo
10-pH = [H+]
b) Výpočet z koncentrácie hydroxidových aniónov (OH-)
pOH = -log [OH-]
alebo
10-pOH = [OH-]
Po výpočte hodnoty pOH ju musíte použiť v nasledujúcom výraze na určenie hodnoty pH.
pH + pOH = 14
Interpretácia hodnôt pH
Na základe znalosti hodnoty pH môžeme určiť, či má daný roztok kyslý, zásaditý alebo neutrálny charakter. Na tento účel stačí použiť nasledujúci schematický vzťah:
Pre hodnoty pH pod 7 = kyslé médium;
Pre pH s hodnotou rovnou 7 = neutrálne médium;
Pre hodnoty pH nad 7 = základné médium.
Príklady
1. príklad: Vedieť, že koncentrácia hydróniových katiónov v roztoku je 2,10-4 mol / L, aká by mala byť hodnota pH tohto roztoku?
Na stanovenie hodnoty pH roztoku z koncentrácie hydrónia (H+), 2.10-4 mol / L, musíme použiť nasledujúci výraz:
pH = -log [H+]
pH = -log [2.10-4 ]
pH = - (log 2 + log 10-4)
pH = -log2 - log10-4
pH = –log 2 - 4. log 10
pH = –0,3 + 4. (1)
pH = -0,3 + 4
pH = 3,7
2. príklad: Roztok tvorený určitou rozpustenou látkou má koncentráciu hydroxidového iónu rovnú 10-11 mol / l. Z tejto koncentrácie môžeme povedať, že hodnota pH tohto roztoku je koľko?
Na stanovenie hodnoty pH roztoku z koncentrácie hydroxidu sa pridá 10-11 mol / L, musíme urobiť nasledovné:
1O Krok: vypočítať hodnotu pOH.
10-pOH = [OH-]
10-pOH = 10-11
Výraz musíme vynásobiť číslom -1, pretože pOH je vždy pozitívna neznáma.
-pOH = -11. (- 1)
pOH = 11
2O Krok: vypočítať hodnotu pH.
pH + pOH = 14
pH + 11 = 14
pH = 14 - 11
pH = 3
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ph.htm
