“Chemická väzba “bol termín, ktorý ako prvý použil Gilbert Newton Lewis v roku 1920 v článku na vysvetlenie prečo že atómy držia spolu, aby vytvorili látky, a tiež to, prečo sa lepia spolu na tisíce rokov starý.
Atómy väčšiny chemických prvkov, ktoré sú doteraz známe a sú uvedené v periodickej tabuľke, sa v prírode nevyskytujú v izolovanej forme. Väčšina materiálov prítomných v našom každodennom živote sú látky, ktoré môžu byť jednoduché (pozostávajúce z atómov iba jedného typu chemického prvku) alebo kompozity (majú atómy dvoch alebo viacerých chemických prvkov veľa rôznych).
Je to tak preto, lebo atómy majú schopnosť vytvárať chemické väzby s inými atómami, ktoré môžu byť rovnakými alebo rôznymi prvkami. Tieto väzby sú také silné, že bez vonkajšieho vplyvu atómy vo väčšine prípadov zostanú spojené tak, ako sú.
Myšlienková mapa: Chemické väzby

* Ak si chcete stiahnuť myšlienkovú mapu v PDF, Kliknite tu!
Napríklad nie je bežné nájsť v prírode voľný atóm kyslíka; nájdeme však niekoľko látok, v ktorých sa zdá byť pripojený k iným atómom. Príkladom jednoduchej látky je plynný kyslík, v ktorom je každá molekula tvorená dvoma viazanými atómami kyslíka (O
2); zatiaľ čo príkladom zloženej látky je voda, kde každá molekula má dva atómy vodíka viazané na atóm kyslíka (H2O).Jediné prvky, ktoré sa nachádzajú v stabilne izolovanej prírode, sú vzácne plyny, teda prvky rodiny 18 periodickej tabuľky (He, Ne, Ar, Kr, Xe a Rn). Všetky tieto prvky majú spoločné to, že majú osem elektrónov v poslednom elektrónovom obale (valenčná vrstva), s výnimkou hélia (He), ktorá má iba jednu elektrónovú škrupinu (vrstvu K) a teda drží dva elektróny, čo je v tom maximálny možný počet elektrónov vrstva.
Teda Gilbert N. Lewis a tiež vedec Water Kossel prišli na to atómy ostatných prvkov sa viažu tak, že majú osem elektrónov (alebo dva, ak máte iba K obal), a tak sa stabilizujú. To bolo potom vytvorené elektronická teória valencie, čo na základe vysvetlenej myšlienky naznačuje, koľko chemických väzieb vytvára atóm prvku.
Preto atómy vytvárajú chemické väzby a snažia sa stratiť, získať alebo zdieľať valenčné škrupinové elektróny, kým nedosiahnu konfiguráciu nasledujúceho vzácneho plynu.Táto teória sa tiež začala nazývať oktetové pravidlo.
Napríklad kyslík je bivalentný, pretože má vo svojej valenčnej škrupine šesť elektrónov. Potrebuje preto prijať ďalšie dva elektróny, aby mal konfiguráciu neónu ušľachtilého plynu (Ne), to znamená, že má osem elektrónov vo valenčnom obale, čo je v tomto prípade obal L. V prípade spomínaného plynného kyslíka a vody máme:
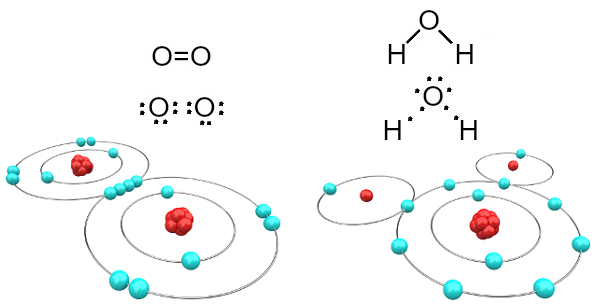
Molekuly kyslíka a vody tvorené kovalentnými väzbami
Upozorňujeme, že v prvom prípade (plynný kyslík - O2), každý atóm kyslíka zdieľa dva elektróny, pričom oba majú vo valenčnej škrupine osem elektrónov. To znamená, že a dvojitá väzba (dve väzby súčasne medzi dvoma atómami).
V prípade vody má každý z dvoch atómov vodíka spoločný elektrón s centrálnym atómom kyslíka a všetky sú stabilné (kyslík má vo valenčnej škrupine osem elektrónov a každý vodík má dva elektróny). Tu sa tiež vytvárajú dve jednoduché spojenia.
Tento typ chemickej väzby, v ktorej musia všetky atómy prijímať elektróny (vodík, nekovy a polokovy) a v ktorej sú elektróny zdieľané v pároch, sa nazýva kovalentná väzba.
Existujú však ešte dva typy chemických väzieb:
(1) iónová väzba → existuje definitívny prenos elektrónov z jedného atómu na druhý. Tento typ väzby sa vyskytuje medzi atómami kovov (ktoré majú tendenciu strácať elektróny) stabilné) a atómy vodíka, nekovy a polokovy (ktoré majú sklon k pobytu elektrónov) stabilný).
Príkladom je chlorid sodný (NaCl - kuchynská soľ), kde sodík je kov, ktorý má tendenciu strácať elektrón, zatiaľ čo chlór je nekovový materiál, ktorý má tendenciu získavať elektróny. Sodík teda daruje(červená šípka)elektrón na chlór, tvoriaci soľ, veľmi stabilná látka. Keďže vyštudujú (čierna šípka) ióny, čo sú chemické látky s opačnými nábojmi (+ a -), jeden ión priťahuje ďalší v okolí a iónové zhluky sa vytvárajú s obrovským počtom iónov, rovnako ako kryštály v kuchynskej soli.

Tvorba chloridu sodného prostredníctvom iónovej väzby
(2) Kovové spojenie → Je to teória, že kovy (ako hliník, zlato, striebro, meď atď.) Sú tvorené zhlukom neutrónových atómov a katióny, ktoré drží pohromade akýsi „oblak“ voľných elektrónov (elektróny, ktoré sa stratili pri tvorbe katiónov) citované). Tento oblak (alebo more) elektrónov by fungoval ako kovová väzba, ktorá by držala atómy pohromade.
Viac podrobností o týchto druhoch chemických väzieb, ako aj o pravidle oktetu, nájdete v súvisiacich článkoch nižšie.
Mind Map Autor: M.e Victor Ricardo Ferrreira
Učiteľ chémie
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-ligacao-quimica.htm
