anorganické soli sú tvorené iónovou asociáciou najmenej jedného katiónu (tvoreného akýmkoľvek kovom alebo amóniom) a aniónu (jednoduchého alebo zloženého).
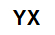
Všeobecný molekulárny vzorec soli
Po pridaní do vody sa soli disociujú a uvoľňujú najmenej jeden katión iný ako hydronium (H+) a anión iný ako hydroxid (OH.)-).
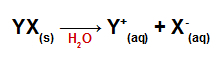
Disociačná rovnica pre každú soľ
Klasifikácia solí
Soli môžu mať vo všeobecnosti nasledujúce klasifikácie:
jednoduchá soľ: soľ tvorená iba jedným katiónom a jedným aniónom. Príklady: NaCl, CaSO4, KCN, NH4CO3 atď.
Hydrogenovaná soľ: má dva katióny (z ktorých jeden musí byť hydrónium) a anión. Príklady: NaHCO3, CaHBO3 atď.
Hydroxylová soľ: má katión a dva anióny (z ktorých jeden musí byť hydroxid). Príklady: MgOHCl, Al (OH)2ClO3 atď.
Hydratovaná soľ: predstavuje molekuly vody spojené s jej kryštalickou štruktúrou. Príklady: CaCl2.2H2O, CuSO4.6H2Atď.
Podvojná soľ: má dva katióny (všetky odlišné od hydrónia) a jeden anión alebo jeden katión a dva anióny (všetky odlišné od hydroxidu). Príklady: Typ4KN, AgFeBO3 atď.
Kamenec: je soľ tvorená dvoma síranmi s katiónmi NOx rovnajúcimi sa +1 a +3 plus 24 molekúl vody. Príklady: Ag2IBA4.Al2(IBA4)3.24H2o, na2IBA4.Sb2(IBA4)3.24H2O
Pravidlo pre pomenovanie soli
Aniónový názov + názov + katiónu
→ K.3PRACH4
Soľ má fosforečnanový anión (PO4-3) a katión draslíka (K.+1), a preto sa volá fosforečnan draselný.
→ Prípad3
Soľ má siričitanový anión (SO3-2) a vápnikový katión (Ca+2), a preto sa volá siričitan vápenatý.
POZNÁMKA: Ak katiónom nie je striebro, zinok alebo prvok, ktorý patrí do rodiny IA, IIA a IIIA, musíme jeho NOX pred menom katiónu uviesť rímskou číslicou.
→ Cu2IBA4
Soľ má síranový anión (SO4-2) a vápenatý katión (Cu+1), a preto sa volá síran meďnatý I.
Hydrogenovaná soľ: Pre túto soľ musíme pred názov aniónu napísať predponu vzťahujúcu sa na množstvo vodíka vo vzorci. Táto predpona musí byť samostatná od slova vodík pomlčkou.
→ NaHCO3
Soľ má hydrogén, uhličitanový anión a katión sodný, takže sa volá monohydrogenuhličitan sodný.
Hydroxylová soľ: Pre túto soľ musíme pred názov aniónu napísať predponu vzťahujúcu sa na množstvo hydroxylových skupín vo vzorci. Táto predpona musí byť samostatná od slova hydroxy pomlčkou.
→ Al (OH)2ClO3
Soľ má dva hydroxyly, chlorečnanový anión a katión hliníka, takže sa volá dihydroxy-chlorečnan hlinitý.
Teraz neprestávajte... Po reklame je toho viac;)
Hydratovaná soľ: Pre túto soľ musíme za názov katiónu napísať predponu vzťahujúcu sa na množstvo molekúl vody vo vzorci. Táto predpona musí byť samostatná od slova hydratovaný pomlčkou.
→ CaCl2.2H2O
Soľ má dve molekuly vody, chloridový anión a katión vápnika, takže sa volá dihydrát chloridu vápenatého.
Podvojná soľ s dvoma katiónmi: Pre túto soľ musíme napísať dvojité slovo v zátvorkách za názvom aniónu a potom najelektropozitívnejšie meno katiónu a druhý katión.
→ AgFeBO3
Táto soľ má okrem borátového aniónu aj striebro (elektropozitívnejší katión) a katión železa II. Jeho názov je borát (dvojitý) zo striebra a železa II.
-
Podvojná soľ s dvoma aniónmi:
Názov najviac elektronegatívneho aniónu + spojovník + názov najmenej elektronegatívneho aniónu + názov de + katiónu
→ Typ4KN
Táto soľ obsahuje katión titánu IV, okrem fosfátu (elektronegatívnejší anión) a kyanidového aniónu. Jeho názov je kyanid titaničitý fosfát IV.
Kamencová soľ: Pre túto soľ ignorujeme všeobecné pravidlo. Stačí napísať výraz kamenec, za ktorým bude názov nábojového katiónu +3 a názov nábojového katiónu +1, oddelené spojkou e.
→ V2IBA4.Sb2(IBA4)3.24H2O
Kamencová soľ má katión antimónu +3 a katión sodíka +1, takže sa volá kamenec a antimon III.
Fyzikálne vlastnosti solí
Pri izbovej teplote sú tuhé;
Majú vysoké teploty topenia a varu;
Sú tvorené z iónových väzieb;
Vedú elektrický prúd v tekutom stave (po fúzii) alebo po rozpustení vo vode;
Spravidla sú rozpustné vo vode, existujú však aj soli, ktoré sa považujú za prakticky nerozpustné.
Chemické vlastnosti solí
Soli sú zlúčeniny, ktoré majú schopnosť chemicky reagovať (za predpokladu, že nemajú rovnaký katión alebo rovnaký anión ako iná látka) s niekoľkými skupinami látok, a to:
Pri dvojitej výmennej reakcii s kyselinou: tvoria novú soľ a novú kyselinu.
Pri dvojitej výmennej reakcii s bázou: tvoria novú soľ a novú bázu.
V reakcia dvojitej výmeny s inou soľou: tvoria dve nové soli.
Niektoré soli majú schopnosť trpieť rozklad pri pôsobení tepla vytvára dve alebo viac nových látok. Ak zahrejeme hydrogenuhličitan sodný (NaHCO3), napríklad, sa rozloží a vytvorí uhličitan sodný (Na2CO3), voda (H2O) a oxid uhličitý (CO2).
Podľa mňa. Diogo Lopes Dias
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
DNI, Diogo Lopes. „Čo sú anorganické soli?“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-sais-inorganicos.htm. Prístup k 28. júnu 2021.
Čo je to chémia?

Prístup na tento odkaz a spoznajte, čo je oxid, spôsob používaný na identifikáciu tejto dôležitej skupiny anorganických látok, ako aj pravidlá pomenovania použité na ich pomenovanie a hlavné klasifikácie (dvojité, kyslé, zásadité, amfotérne a neutrálne), ktoré môžu prijímať.
Chémia

Sal Light, zložený z chloridu sodného a chloridu draselného, pacient s vysokým krvným tlakom, nízkym obsahom sodíka, kovový sodík, kuchynská soľ, sodné ióny.
Chémia

Každodenné soli, uhličitan vápenatý, chlorid sodný, fluorid sodný, dusičnan draselný, dusičnan sodný sodík, uhličitan sodný, hydrogenuhličitan sodný, hydrogenuhličitan sodný, siričitan sodný, soľka, sóda.


