O kyselina mravčia dostane svoje meno, pretože jeho prvé získanie bolo prostredníctvom destilácie červených mravcov (z lat umakart = mravec), ktorí vstrekujú túto karboxylovú kyselinu svojim uhryznutím a spôsobujú silnú bolesť, opuch a svrbenie.
Jeho oficiálnou nomenklatúrou je však kyselina metánová, ktorej štruktúrny vzorec je uvedený nižšie:

Okrem mravcov sa kyselina metánová nachádza aj vo včelách, žihľave, boroviciach a niektorých druhoch ovocia.
Pri izbovej teplote je bezfarebný, tekutý, žieravý, silne zapáchajúci a dráždivý. Táto kyselina sa používa ako moridlo pri výrobe oxidu uhoľnatého, pri liečbe reumatizmu, pri výrobe kyseliny šťaveľovej, ako germicídnej látky, ako dezinfekčného prostriedku a pri výrobe ďalších výrobkov Organické.
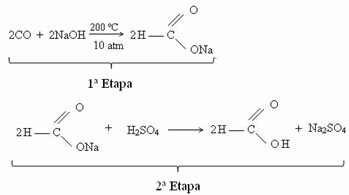
V súčasnosti sa kyselina mravčia získava reakciou medzi oxidom uhoľnatým a lúhom sodným. Táto reakcia je technikou podobnou tej, ktorú vyvinul v roku 1855 francúzsky chemik Marcellin Berthelot (1827-1907). Ďalej máme túto reakciu, pri ktorej sa najskôr získa metanoát sodný, ktorý po reakcii s kyselinou sírovou produkuje kyselinu metánovú ako jeden z produktov:
Teraz neprestávajte... Po reklame je toho viac;)
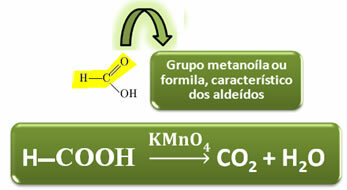
Na rozdiel od iných karboxylových kyselín má kyselina mravčia funkčnú skupinu aldehydy, čo jej dáva vlastnosť pôsobiť ako reduktor. Redukuje reaktívne látky Fehling a Tollens, oxiduje sa na oxid uhličitý a vodu.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Kyselina mravčia“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/Acido-formico.htm. Prístup k 28. júnu 2021.