V adičné reakciev alkény(uhľovodíky, ktoré majú dvojitú väzbu medzi dvoma atómami uhlíka), je väzba pí medzi dvoma uhlíkmi prerušená a každý z uhlíkov sa pripája k novému atómu. Pozri:
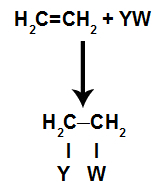
Všeobecný schematický model adičnej reakcie
Princípy adičnej reakcie
a) Rozbitie pí spojky
Väzba pí sa ľahko zlomí, pretože je slabšou väzbou ako väzba sigma. Aby sa tak však stalo, je potrebné, aby bol alkén vystavený podmienkam, ktoré toto narušenie spôsobujú. Po rozbití väzby pí medzi dvoma uhlíkmi sa na každom z uhlíkov, ktoré sa na ňom nachádzajú, vždy objaví väzobné miesto (pre nové atómy).
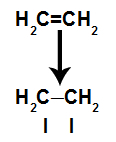
Schéma zobrazujúca zlomenie odkazu pi
b) Podmienky prerušenia väzby pí
Faktory, ktoré uprednostňujú prerušenie väzby pí, sú:
Použitie katalyzátorov;
Kúrenie;
Prítomnosť kyseliny v reakčnom prostredí.
c) Výskyt adičnej reakcie
Väzbové miesta vytvorené po rozbití pi-väzby budú vždy obsadené atómami reaktantu, ktorý je v rovnakom kontajneri ako alkén. Adičná reakcia je pomenovaná podľa typu činidla zmiešaného s alkénom.
Typy adičných reakcií v Alkenes
a) Hydrogenácia
Alkén sa zmieša s plynným vodíkom (H2) v nádobe a podrobený pôsobeniu pevného katalyzátora (nikel, platina alebo paládium) a zahrievaniu (Δ).
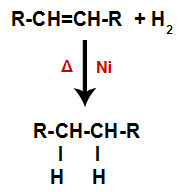
Všeobecná schéma hydrogenačnej reakcie v alkénoch
Prítomnosť katalyzátora a zahrievanie spôsobujú väzbu pi alkénu a väzbu sigma medzi vodíkmi H2 byť zlomený rýchlejšie. S tým máme vytvorenie dvoch väzbových miest v alkéne a dvoch voľných atómov vodíka v reakčnom prostredí.

Vytvorenie väzbových a separačných miest pre atóm
Hneď potom teda každý voľný atóm vodíka obsadí jedno z väzbových miest vytvorených v alkéne. Pretože vytvorená látka má iba uhlíky a vodíky, rovnako ako iba jednoduché väzby medzi uhlíkmi, je to alkán.
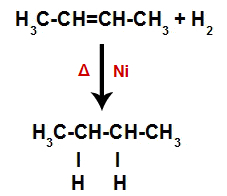
Rovnica predstavujúca vznik alkánu pri hydrogenácii
B) Halogenácia
Alkén sa zmieša s jednoduchými látkami (F.2Cl2, br2 Ahoj2) tvorený halogény (chlór, fluór, jód a bróm) v nádobe a vystavený pôsobeniu svetla (λ) a ohrevu (Δ).

Všeobecná schéma halogenačnej reakcie v alkénoch
Pôsobením svetla a ohrevu sa rýchlejšie rozbije väzba pí alkénu a väzba sigma medzi látkami tvorenými halogénom. Týmto vznikli dve väzbové miesta v alkéne a dva voľné atómy halogénu v reakčnom prostredí.
Teraz neprestávajte... Po reklame je toho viac;)

Vytvorenie väzbových a separačných miest pre atóm
Okamžite potom teda každý voľný atóm halogénu zaberá jedno z väzbových miest vytvorených v alkéne. Pretože vytvorená látka má halogén spojený so štruktúrou zloženou z uhlíkov a vodíkov, je to a organický halogenid.

Rovnica predstavujúca tvorbu organického halogenidu pri halogenácii
c) Hydratácia
Alkén sa zmieša s vodou (vod2O) v nádobe a podrobený pôsobeniu katalyzátora (v tomto prípade kyseliny sírovej).
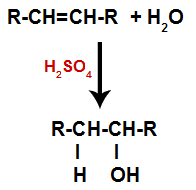
Všeobecná schéma hydratačnej reakcie v alkénoch
Prítomnosť kyseliny sírovej v reakcii vedie k rýchlejšiemu rozpadu pi väzby alkénu a sigma väzby medzi vodíkom (H) a hydroxylom (OH). Týmto vznikli dve väzbové miesta v alkéne a jedno voľné vodíky a druhé hydroxylové skupiny v reakčnom prostredí.
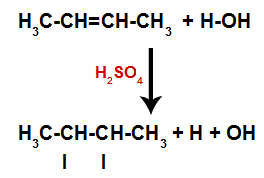
Vytvorenie väzbových a separačných miest pre atóm
Krátko nato teda vodík a hydroxylová skupina zaujímajú jedno z väzbových miest vytvorených v alkéne. Pretože vytvorená látka má hydroxylové skupiny viazané na nasýtený uhlík (vytvára iba jednoduché väzby), je to alkohol.
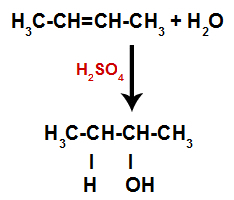
Rovnica predstavujúca tvorbu alkoholu pri hydratácii
d) Pridanie s halogenovodíkmi
Alkén sa zmieša s halogénovanou anorganickou kyselinou (HF, HI, HCl, HBr) v nádobe.

Všeobecná schéma reakcie halogenidu kyseliny v alkénoch
Prítomnosť kyseliny v reakcii spôsobí, že sa pi väzba alkénu rýchlejšie rozpadne. Jednoduchá väzba v kyseline je prerušená, pretože tieto látky prirodzene ionizujú. V alkéne sú teda vytvorené dve väzbové miesta a v reakčnom prostredí je prítomný voľný vodík a halogén.
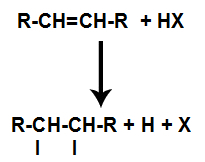
Vytvorenie väzbových a separačných miest pre atóm
Krátko nato teda vodík a halogén obsadzujú jedno z väzbových miest vytvorených v alkéne. Pretože vytvorená látka má halogén spojený so štruktúrou zloženou z uhlíkov a vodíkov, je to organický halogenid.
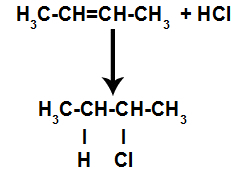
Rovnica predstavujúca tvorbu organického halogenidu pri halogenácii
Podľa mňa. Diogo Lopes Dias
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
DNI, Diogo Lopes. „Adičné reakcie v Alkénoch“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm. Prístup k 28. júnu 2021.
Chémia

Alkány, uhľovodíky, metán, nasýtené reťazce, alifatické, parafíny, palivá, benzín, minerálny vosk, ropa, ropné bridlice, zemný plyn, petrochemický priemysel.
Chémia

Alkény, plyn, etén, etylén, plasty, syntetický kaučuk, farbivá, syntetické tkaniny, výbušniny, krakovanie ropy, polyetylén, plynný olej, olefíny, uhľovodíky, reťazové acyklický oxid uhličitý.
Alkyny, etické uhľovodíky, acetylénové uhľovodíky, acyklický uhlíkový reťazec, uhlíkový reťazec homogénny, nenasýtený uhlíkový reťazec, trojitá väzba, PVC, PVA, acetylén, syntetické gumy, plasty, drôty textil.
