Vy aldehydy a ketóny sú to veľmi podobné organické funkcie. Oba majú vo svojej štruktúre karbonylovú funkčnú skupinu (C = O), s jediným rozdielom, že v prípade aldehydy, objavuje sa vždy na konci uhlíkového reťazca, to znamená, že jedným z karbonylových uhlíkových ligandov je vodík; ketóny majú karbonylovú skupinu medzi dvoma ďalšími atómami uhlíka.
Aldehydová funkčná skupina:Funkčná skupina ketónov:
O O
║ ║
C C ─ H C C ─ C
Z tohto dôvodu existujú prípady funkčnej izomérie medzi aldehydmi a ketónmi. Napríklad nižšie uvádzame dva funkčné izoméry, ktoré majú rovnaký molekulárny vzorec (C3H6O), ale jeden je aldehyd (propanal) a druhý je ketón (propanón). Zistite, ako to úplne mení ich vlastnosti a použitie:
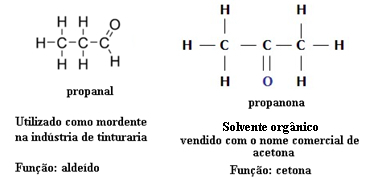
Príklad izomérie funkcií medzi aldehydom a ketónom
Predstavte si, že ste v laboratóriu a nájdete injekčnú liekovku s bezfarebnou tekutinou, ktorá má iba molekulárny vzorec C.3H6O. Čo by ste robili, aby ste zistili, či je to ketón alebo aldehyd?
Na vyriešenie takýchto problémov, Existujú spôsoby diferenciácie aldehydov a ketónov založené na reakcii týchto zlúčenín na slabé oxidačné činidlá. Ako je uvedené nižšie, keď čelia slabým oxidantom, aldehydy reagujú oxidáciou, zatiaľ čo ketóny nereagujú. Hovoríme toaldehydy pôsobia ako redukčné činidlá, ale ketóny nie, reagujú iba ako redukčné činidlá pri kontakte s energetickými oxidantmi.
Aldehydy + Slabé oxidačné činidlá → karboxylová kyselina
O O
║ ║
C ─ C ─ H + [O] → C ─ C ─ OH
Ketóny + slabé oxidanty → Nereagujte
O
║
C ─ C ─ C + [O] → Žiadna reakcia nenastane
Na základe toho stačí uskutočniť túto reakciu a zistiť, či zlúčenina reaguje alebo nie. Ak reaguje, vieme, že je to aldehyd; ak nereaguje, je to ketón.
Okrem toho sú produkty tvorené pri týchto oxidačných reakciách aldehydu celkom viditeľné a dochádza k farebným zmenám, ako bude uvedené neskôr.
Existujú tri hlavné spôsoby diferenciácie aldehydov a ketónov, ktoré sú:
1 - Tollens Reactive: Toto činidlo je a amoniakálny roztok dusičnanu strieborného, tj. obsahuje dusičnan strieborný (AgNO3) a prebytok hydroxidu amónneho (NH4OH):
AgNO3 + 3 NH4OH → Ag (NH3) OH + NH4NA3 + 2 H2O
Tollens Reactive (pomenované podľa nemeckého chemika Bernharda Tollensa (1841-1918))
Ako je vysvetlené v texte Výroba strieborného zrkadlakeď sa aldehyd privedie do kontaktu s Tollens reaktívne, oxiduje sa na zodpovedajúcu karboxylovú kyselinu, zatiaľ čo ióny striebra sa redukujú na Ag0 (kovové striebro). Ak sa táto reakcia uskutočňuje napríklad v skúmavke, bude sa toto kovové striebro usadzovať na stenách skúmavky, čo vedie k vytvoreniu filmu nazývaného strieborné zrkadlo. Tento pozorovaný výsledok je veľmi krásny a používa sa v procese výroby priemyselných zrkadiel.
Reakciu, ktorá sa uskutoční, je možné charakterizovať nasledovne:
O O
║ ║
R ─ C ─ H + H2O → R ─ C ─ OH + 2e- + 2 H+
2 Ag+ + 2e- → 2 ag0
2 NH3 + 2 H+ → 2 NH4+
O O
║║
R C ─ H + 2 Ag+ + 2 NH3 + H2O → R C ─ OH + 2 Ag0 + 2 NH4+
aldehyd Mýta reagujúkarboxylová kyselina metalické striebro (strieborné zrkadlo)
Na druhej strane, ak necháme ketón reagovať s Tollensovou reaktívou, nedôjde k tvorbe kovového striebra, pretože ketóny nemôžu redukovať ióny Ag.+.
2 - Fehlingov reaktívny: Táto reaktívna látka je modrý roztok síranu meďnatého II (CuSO4) v bázickom prostredí, pretože sa zmieša s ďalším roztokom vytvoreným z hydroxidu sodného (NaOH) a vínanu sodného a draselného (NaOOC-CHOH-CHOH-COOK). K roztoku síranu meďnatého II sa pridá vínan, aby sa stabilizoval a zabránilo sa jeho zrážaniu.
CUSO4 + 2 NaOH → Na2IBA4 + Cu (OH)2
Fehling Reactive (pomenovaný podľa nemeckého chemika Hermanna von Fehlinga (1812-1885))
Pri kontakte s Fehlingovou reaktívnou látkou vytvára aldehyd oxidáciou karboxylovú kyselinu, zatiaľ čo ióny medi (Cu)2+) prítomné v strede sú redukované a vytvárajú červenohnedú zrazeninu (viac tehlovej farby), ktorou je oxid meďný. Ketóny naopak nereagujú - pretože nemôžu redukovať ióny Cu2+.
O O
║ ║
R ─ C ─ H + 2 Cu (OH)2 → R ─ C ─ OH + Ass2O + 2 H2O
aldehyd červenohnedá zrazenina
3- Benediktova reaktívna: Táto reaktívna látka je tiež tvorená roztokom síranu meďnatého II (Cu (OH)2) v základnom médiu, ale zmieša sa s citranom sodným.
Rovnako ako pri Fehlingovom činidle, aj v prípade reakcie medzi aldehydom a Benediktovým činidlom existujú ióny medi (Cu2+) prítomné v médiu, ktoré sú redukované a tvoria červený oxid meďný.
Toto činidlo sa široko používa v testoch na zisťovanie prítomnosti a obsahu glukózy v moči. Glukóza má vo svojej štruktúre aldehydovú skupinu, takže pri týchto testoch reaguje s Benediktovým činidlom prítomným v pásoch. Odtiaľ stačí porovnať farbu pásky s farbou stupnice na obale produktu.

Na stanovenie obsahu glukózy v moči sa používa Benediktovo činidlo.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm
