Один буферный раствор это смесь, используемая для предотвращения изменения pH или pOH среды при добавлении сильных кислот или сильных оснований.
Есть два типа буферного раствора:
1. Смесь слабой кислоты с ее сопряженным основанием;
2. Смесь слабого основания с его конъюгированной кислотой.
Давайте посмотрим на примеры каждого из них и на то, как они работают при добавлении небольшого количества сильной кислоты или основания в среду:
1. Смесь слабой кислоты с ее сопряженным основанием:
Для образования такого раствора слабую кислоту смешивают с солью того же аниона, что и кислота.
Например, рассмотрим буферный раствор, состоящий из уксусной кислоты (H3CCOOH(здесь)) и ацетат натрия (H3CCOONa(s)). Обратите внимание, что оба имеют ацетат-анион: (H3CCOO-(здесь)). Концентрация этих ионов практически обусловлена большой диссоциацией соли. Кислотная ионизация мала.

Теперь обратите внимание, что происходит при следующих возможностях добавления:
- Добавление небольшого количества сильной кислоты:
Добавление сильной кислоты увеличивает концентрацию иона гидроксония H
3О+1, а поскольку уксусная кислота является слабой кислотой, ацетат-анион имеет высокое сродство к протону (H+) гидроксоний. Таким образом они вступают в реакцию и образуется больше уксусной кислоты:
В результате pH среды практически не меняется. Однако, если добавляется все больше и больше сильной кислоты, наступит время, когда весь ацетат-анион будет израсходован, и эффект буферизации прекратится.
- Добавление небольшого количества прочного основания:
Добавление сильного основания увеличивает концентрацию ионов ОН.-. Но эти ионы нейтрализуются ионами H3О+1 высвобождается при ионизации уксусной кислоты:

При этой реакции концентрация ионов H3О+1(здесь) будет уменьшаться, и произойдет смещение равновесия в смысле увеличения кислотной ионизации, и, следовательно, изменение pH раствора будет очень небольшим. Концентрация ионов H3О+1(здесь) он будет практически постоянным.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
В этом случае также существует предельная емкость буфера. Следовательно, если мы будем добавлять все больше и больше основания, баланс ионизации кислоты будет все больше и больше сдвигаться в сторону ее ионизации, пока не будет израсходована вся кислота.
2. Смесь слабого основания с его конъюгированной кислотой:
Этот тип буферного раствора состоит из слабого основания и раствора соли, которые содержат тот же катион, что и основание.
Например, рассмотрим буферный раствор, образованный гидроксидом магния, MgOH.2 (водн.) (слабое основание) и хлорид магния, MgCl2 (с) (соль). Оба содержат катион магния (Mg2+(здесь)). Практически все ионы магния, присутствующие в среде, образуются в результате диссоциации соли, поскольку диссоциация основания слабая:
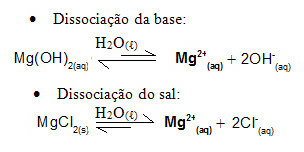
- Добавление небольшого количества сильной кислоты:
В этом случае ионы H3О+1 поступающие из-за добавления сильной кислоты будут нейтрализованы ионами ОН-, возникающие из-за слабой диссоциации оснований. Это сместит базовый баланс диссоциации вправо.
Таким образом, изменение pH (если оно есть) будет очень небольшим, потому что концентрация ионов OH- остается постоянным. Эффект буферизации прекратится, когда вся основа будет диссоциирована.
- Добавление небольшого количества прочного основания:
Добавленное сильное основание подвергается диссоциации, высвобождая ионы OH.-. Поскольку гидроксид магния является слабым основанием, магний, высвобождающийся при диссоциации соли, будет иметь большую тенденцию реагировать с ОН.-:

Следовательно, увеличение количества ионов ОН- компенсируется пропорциональным увеличением Mg (OH)2 (водн.). В результате pH не претерпевает серьезных изменений.
Этот эффект заканчивается, когда весь катион магния израсходован.
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Что такое буферный раствор?»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm. Доступ 28 июня 2021 г.
Химия

Проверьте свои знания и узнайте больше с этим списком решенных упражнений на химические весы. Благодаря этому материалу вы сможете лучше понять, как работают константы равновесия (Kp, Kc и Ki), сдвиг равновесия, pH и pOH, а также равновесие в так называемых буферных растворах.
Раствор, твердый раствор. Жидкий раствор, газообразный раствор, растворы, образованные газом и жидкостью, растворы, образованные жидкостями.