THE самовосстановление или реакция диспропорционирования это тип окислительно-восстановительной реакции, в которой один и тот же химический элемент подвергается окисление и сокращение. Давайте посмотрим на два примера этого типа реакции и на то, как уравновесить их с помощью окислительно-восстановительного метода:
1-й пример:
НА2- + H+ → НЕТ3- + НЕТ + H2О
- Вычисляя степени окисления (NOX) всех атомов и ионов, участвующих в реакции, можно проверить, кто окислялся, а кто реагировал:
+3 -2 +1 +5 -2 +2 -2 +1 -2
НА2- + H+ → НЕТ3- + НЕТ + H2О
- Обратите внимание, что азот был разновидностью, которая реагировала и окислялась:
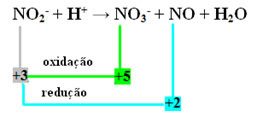
- Чтобы сбалансировать эту реакцию за счет окислительно-восстановительного потенциала, мы должны соотнести NOX с продуктами, а не с реагентами:
НА3- = ∆Nox = 5 - 3 = 2
NO = ∆Nox = 3 - 2 = 1
- Обращая ∆NOX на коэффициенты, получаем:
НА3- = ∆NOX = 2 → 2 будет коэффициент NO
НЕТ = ∆NOX = 1→ 1 будет коэффициент NO3-
НА2- + H+ → 1 НА3- + 2 NO + H2О
- Таким образом, мы уже знаем, что в продукте 3 N, поэтому коэффициент NO2- будет 3:
3 НЕТ2- + H+ → 1 НЕТ3- + 2 НО + Н2О
- Для определения коэффициентов при H+ и из H2О, помните, что количество полученных электронов равно тому же количеству пожертвованных электронов; таким образом, заряд реагента будет равен загрузке продукта. Таким образом мы можем составить следующую схему:
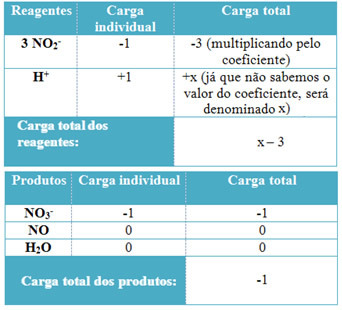
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Исходя из этой информации, получаем, что общий заряд реагентов равен х - 3 и продукт равен -1. Как указано, обвинения обоих должны быть равны. Поскольку у нас уже есть общая загрузка продуктов, мы можем выполнить простой расчет, чтобы узнать, каким будет значение x:
х -3 = -1
х = -1 +3
х = 2
Таким образом, коэффициент при H+ равно 2 и, следовательно, H2Будет 1:
3 НЕТ2- + 2 часа+ → 1 НЕТ3- + 2 НО + 1 Ч2О
2-й пример:
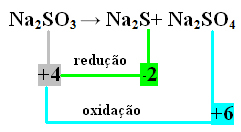
В данном случае именно S подверглась восстановлению и окислению одновременно. Таким образом, как и ранее, мы можем связать NOX с продуктами и инвертировать их значения, присвоив им коэффициенты:
В2 S = ∆Nox = 4 - (-2) = 6 → 6 будет коэффициент при Na2 ТОЛЬКО4
В2 ТОЛЬКО4= ∆Nox = 6 - 4 = 2 → 2 будет коэффициент при Na2 s
В2 ТОЛЬКО3→ 2 В2 Y + 6 В2 ТОЛЬКО4
Поскольку во 2-м лимбе 8 сер, коэффициент Na2 ТОЛЬКО3 будет 8:
8 дюймов2 ТОЛЬКО3→ 2 дюйма2 S + 6 дюймов2 ТОЛЬКО4
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Реакции самоокисления»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm. Доступ 28 июня 2021 г.