THE солевой гидролиз между сильными кислотами и основаниями это происходит, когда катион в соли не взаимодействует с анионом в воде, а анион в соли не взаимодействует с катионом в воде. Гидролиз между катионами и анионами соли и воды происходит только тогда, когда образующийся продукт представляет собой слабую кислоту, слабое основание или и то, и другое. Постепенно изучите гидролиз солей между сильными кислотами и сильными основаниями:
а) Шаг 1: ионизация воды
Вода - это вещество, способное страдать автоионизация, то есть производит катион гидроксония (H+) и гидроксид-анион (OH-) от его структуры.
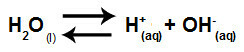
Уравнение, описывающее самоионизацию воды
б) Шаг 2: Диссоциация соли
Когда соль добавляется в воду, она проходит процесс диссоциации. Поскольку соль представляет собой ионное соединение, в воде ее катионы и анионы выделяются в среду, как в приведенном ниже уравнении:
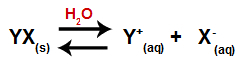
Уравнение, представляющее диссоциацию любой соли
в) Шаг 3: Солевой гидролиз сильных кислот и оснований.
Для сильной кислоты: когда анион соли соединяется с H
+ воды с образованием HCl, HBr, HI или другой кислоты, в которой вычитание числа атомов кислорода на число атомов водорода равно или больше 2, мы будем иметь сильная кислота. Следовательно, комбинации между упомянутыми ионами не происходит.Для прочного основания: когда катион соли, принадлежащей к семействам IA (щелочные металлы) или IIA (щелочноземельные металлы, кроме магния), объединен с группой OH- воды, это сформирует прочный фундамент. Следовательно, комбинации между упомянутыми ионами не происходит.
Когда ионы соли не взаимодействуют с ионами воды, мы имеем следующее уравнение:
Не останавливайся сейчас... После рекламы есть еще кое-что;)
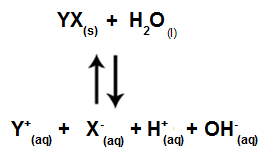
Уравнение, показывающее все ионы, присутствующие в растворе
Таким образом, поскольку ионы соли не взаимодействуют с ионами воды, ионы соли не способствуют каким-либо изменениям в конечном растворе. Таким образом, мы можем записать уравнение гидролиза соли между сильными кислотами и сильными основаниями просто с помощью уравнения ионизации воды.
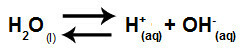
Уравнение, представляющее гидролиз сильных кислот и оснований
г) Пример гидролиза соли между сильными кислотами и основаниями.
Когда мы добавляем хлорат калия в воду (KClO3), соль диссоциирует и высвобождает катион калия (K+) и хлорат-анион (ClO3-) посередине.
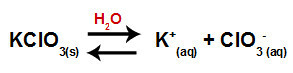
Уравнение диссоциации хлората калия
Важно помнить, что вода подвергается самоионизации и снабжает среду катионом гидроксония (H+) и гидроксид-анион (OH-). Теперь мы должны оценить взаимодействие между ионами соли и воды.
Когда H+ взаимодействует с ClO3-, образует хлорную кислоту (HclO3). Поскольку вычитание количества атомов кислорода на количество ионизируемых водородов в хлорной кислоте равно 2, это сильно. Следовательно, взаимодействия между ионами не происходит.
Когда катион K+ взаимодействует с анионом ОН-, мы имеем образование сильного основания, так как калий является щелочным металлом. Следовательно, взаимодействия между ионами не происходит.
Уравнение, которое представляет собой гидролиз солей между сильными кислотами и основаниями при растворении хлората калия в воде:
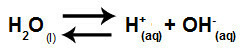
Химическое уравнение гидролиза хлората калия
Автор: Диого Лопес Диас
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
ДНИ, Диого Лопес. «Гидролиз солевого раствора между сильными кислотами и сильными основаниями»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm. Доступ 28 июня 2021 г.
Химия

Проверьте свои знания и узнайте больше с этим списком решенных упражнений на химические весы. Благодаря этому материалу вы сможете лучше понять, как работают константы равновесия (Kp, Kc и Ki), сдвиг равновесия, pH и pOH, а также равновесие в так называемых буферных растворах.



