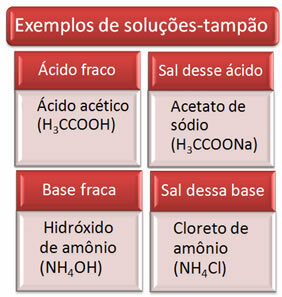
Буферный раствор обычно представляет собой смесь слабой кислоты и соли этой кислоты или слабого основания и соли этого основания. Этот раствор предназначен для предотвращения очень больших колебаний pH или pOH раствора.
Ниже приведены несколько примеров буферных растворов:
Эффективность буферного раствора можно увидеть в нашей крови, где даже при добавлении кислоты или основания в небольших количествах в плазму крови практически не изменяется ее pH.
Как это происходит, учитывая, что если мы добавляем в воду кислоты или основания, ее pH быстро изменяется?
Человеческая кровь представляет собой слегка щелочную буферную систему, то есть представляет собой буферную жидкость: ее pH остается постоянным между 7,35 и 7,45. Один из самых интересных и важных буферов в крови - угольная кислота (H2CO3) и солью этой кислоты бикарбонатом натрия (NaHCO3).
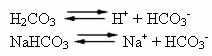
Таким образом, в этом буферном растворе присутствуют следующие виды:
ЧАС2CO3: присутствует в больших количествах, так как это слабая кислота, мало подвержена ионизации;
ЧАС+: от ионизации H2CO3;
HCO3-: также присутствует в больших количествах из-за ионизации H2CO3 и диссоциация солей (NaHCO3);
В+: от ионизации NaHCO3;
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Если к этому раствору добавить небольшую концентрацию кислоты, произойдет его ионизация с образованием катионов H.+, который будет реагировать с анионами HCO3- присутствует в среде, образуя неионизированную угольную кислоту. Изменения pH нет.
Если добавляется основание, образуются анионы ОН.-. Эти ионы соединяются с катионами H+, от ионизации H2CO3. Таким образом, анионы ОН- нейтрализуются, поддерживая pH среды.
В дополнение к упомянутому буферному раствору в крови присутствуют еще два: H2ПЫЛЬ4/HPO42- и немного белков. Если бы в крови не было таких буферных растворов, диапазон pH мог бы быть серьезно искажен. Если pH крови поднимается выше 7,8, это называется алкалозом. Если pH упадет слишком сильно, ниже 6,8, это будет состояние ацидоза. Оба являются опасными состояниями, которые могут привести к смерти.

Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Буферный раствор в крови человека»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/solucaotampao-no-sangue-humano.htm. Доступ 28 июня 2021 г.