Гибридизация это название, данное слиянию или объединению неполных атомных орбиталей, явлению, которое увеличивает количество ковалентные связи что может делать атом. Помните, что орбиталь - это та область атома, где больше вероятность найти электрон.
Чтобы узнать количество связей, образующихся в атоме, и понять феномен гибридизация, необходимо знать некоторые фундаментальные моменты об атоме:
1О точка: энергетические подуровни
Энергетические подуровни, которые может иметь атом, - это s, p, d, f.
2О точка: количество орбиталей на подуровень
Каждый энергетический подуровень имеет разное количество орбиталей, как мы видим ниже:
Подуровень s: 1 орбитальный;
p подуровень: 3 орбитали;
Подуровень d: 5 орбиталей.
Общее представление этих орбиталей делается следующим образом:
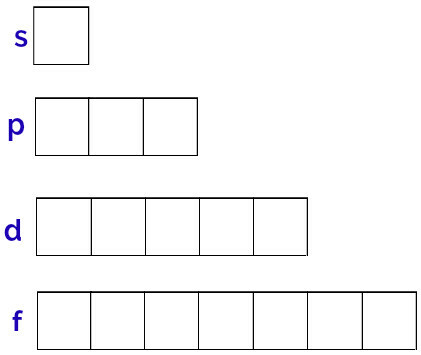
Представление орбиталей каждого подуровня
Согласно Паули, орбиталь может иметь максимум 2 электрона, причем спины (вращательные движения) противоположные.
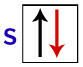
Представление s-орбитали с ее электронами
Согласно Хунду, орбиталь подуровня получает свой второй электрон только тогда, когда все другие орбитали этого подуровня уже получили первый электрон.
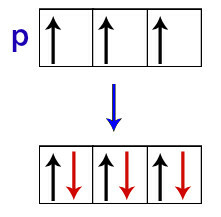
Распределение электронов на p-подуровневых орбиталях
3О точка: электронная рассылка
Чтобы понять гибридизацию и количество связей, которые создает атом, необходимо выполнить следующее: электронное распределение на диаграмме Линуса Полинга.

Диаграмма Линуса Полинга
Помня, что максимальное количество электронов на каждом подуровне:
s = 2 электрона;
p = 6 электронов;
d = 10 электронов;
f = 14 электронов.
После этого краткого обзора мы можем теперь определить что такое гибридизация. Для этого воспользуемся химическим элементом бором (атомный номер = 5) в качестве примера.
Выполняя электронное распределение бора, мы имеем:
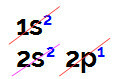
Электронное распределение бора на диаграмме Линуса Полинга
В этом распределении можно наблюдать, что бор имеет 2 электрона на s-подуровне и 1 электрон на p-подуровне валентный слой.
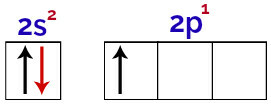
Электроны на орбиталях валентного слоя бора
Поскольку бор имеет 1 неполную орбиталь, поэтому он должен образовывать только одну ковалентную связь, поскольку количество связей всегда напрямую связано с количеством неполных орбиталей.
Таким образом, когда атом бора получает энергию от внешней среды, его электроны, особенно в валентной оболочке, становятся возбужденными. Это приводит к тому, что один из электронов с s-орбитали покидает и занимает одну из пустых p-орбиталей, в результате чего образуются 3 неполные атомные орбитали, как вы можете видеть на следующем изображении:

Представление возбужденного состояния атома бора
Наконец, существует объединение неполной s-орбитали с неполными p-орбиталями. Этот союз называется гибридизация. Поскольку у нас есть слияние s-орбитали с двумя p, это называется гибридизация зр2.
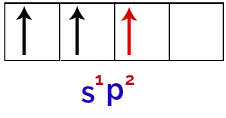
Представление гибридизированных орбиталей в атоме бора
Помимо бора, феномену гибридизации подвергаются некоторые другие химические элементы, такие как сера (S), ксенон (Xe), люминофор (П), углерод (Ç), бериллий (Быть).
Автор: Диого Лопес Диас
Источник: Бразильская школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm
