Ковалентная связь возникает, когда два атома разделяют пары электронов, чтобы получить электронную конфигурацию благородный газ (с 8 электронами в валентной оболочке или с 2, в случае с электронами только с K-оболочкой), согласно правилу октет.
Однако есть особые случаи ковалентных связей, в которых общая электронная пара исходит только от одного из атомов, который уже стабилен. Ранее этот тип ковалентной связи назывался дательный падеж, сегодня его чаще называют координировать.
Посмотрите несколько примеров, чтобы понять, как это происходит:
- CO (окись углерода):
Углерод имеет 4 электрона в валентной оболочке. Следовательно, согласно правилу октетов, чтобы быть стабильным, он должен получать еще 4 электрона, всего 8. Кислород, с другой стороны, имеет 6 электронов в валентной оболочке и ему необходимо получить 2 электрона, чтобы получить конфигурацию благородного газа неона.
Итак, во-первых, углерод и кислород разделяют две пары электронов, так что кислород стабилен:
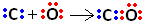
Однако углерод остается нестабильным, поскольку у него по-прежнему 6 электронов, и ему нужно 2. Следовательно, кислород, который уже является стабильным, делит одну из своих пар электронов с углеродом, то есть создает с ним дативную связь, что делает его стабильным:

Обратите внимание, что координатная ковалентная связь может быть представлена тире, как и обычная ковалентная связь.
- ТОЛЬКО2 (Диоксид серы):
У каждого атома серы и кислорода в валентных оболочках по 6 электронов, поэтому каждый из них должен получить по 2 электрона. Первоначально сера образует две общие ковалентные связи, разделяя две пары электронов с одним из атомов кислорода, причем обе остаются стабильными с 8 электронами.
Но другой атом кислорода нестабилен, поэтому сера разделяет с ним пару своих электронов через координированную или дативную ковалентную связь:
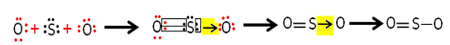
Обратите внимание, что в этом случае у нас есть три атома в молекуле, поэтому может происходить миграция связи от одного атома к другому. Молекула диоксида серы также может быть представлена так: O ─ S = O.
Мы называем это явление связи резонанс. См. Еще три примера в таблице ниже:
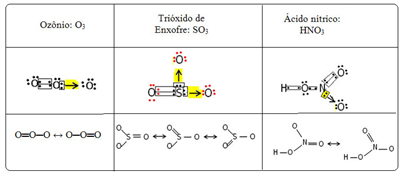
Возможные конструкции называются резонансные структуры или же канонические формы.
Этот тип связи также встречается при образовании ионов, как и в случае ионов гидроксония (H3O+) и аммония (NH4+).
Во-первых, катион H+ он образуется, когда водород теряет свой единственный электрон, оставляя его с положительным зарядом. Таким образом, чтобы быть стабильным, необходимо получить два электрона. Это происходит за счет дательной связи с водой (в случае иона гидроксония) и с аммиаком (в случае иона аммония). Смотреть:

Дженнифер Фогача
Окончила химический факультет
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm
