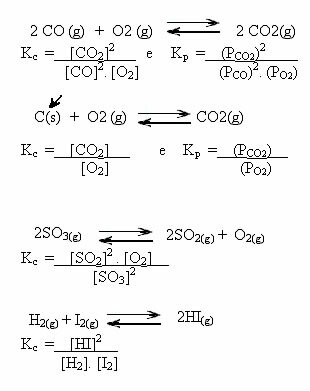
Водные растворы солей могут иметь щелочной или кислый характер в зависимости от формы, в которой они были получены. Посмотрите через гидролиз солевого раствора, как кислотность и основность влияют на конечный продукт реакции:
Солевой гидролиз сильной кислоты и слабого основания
Реакция между солью и водой может давать сильную кислоту и слабое основание в качестве продуктов, см. Пример:
Водно-солевой раствор нитрата аммония (NH4НА3) имеет pH менее 7, следите за процессом его получения:
NH4НА3 (водн.) + H2О (л) ↔ NH4ОН (водн.) + HNO3 (здесь)
Сильная кислота слабое основание
Гидролиз соли (NH4НА3) образует кислый раствор из-за присутствия азотной кислоты (HNO3).
Солевой гидролиз слабой кислоты и слабого основания
NH4CN (водн.) + HOH (л) ↔ NH4ОН (водн.) + HCN (водн.)
Слабое основание слабая кислота
Вышеприведенное уравнение представляет собой диссоциацию цианидной соли аммония (NH4CN). В ходе реакции образуются слабое основание и кислота. И основание, и кислота не ионизируются, то есть не подвергаются ионизации, отсюда и причина классификации.
Гидролиз солей сильной кислоты и сильного основания
NaCl (водн.) + HOH (l) ↔ NaOH (водн.) + HCl (водн.)
сильная сильная кислотная основа
Водный раствор соли NaCl (хлорида натрия) имеет нейтральный характер (pH = 7). Во время описанной выше обратимой реакции происходит образование гидроксида натрия (NaOH) и соляной кислоты (HCl), которые классифицируются как сильные.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Лирия Алвес
Окончила химический факультет
Бразильская школьная команда
Узнать больше!
солевой гидролиз - посмотреть, как получить слабую кислоту и сильное основание.
Решения - Физико-химический - Химия - Бразильская школа
Хотели бы вы ссылаться на этот текст в учебе или учебе? Посмотрите:
SOUZA, Líria Alves de. «Водный раствор солей»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/solucao-aquosa-sais.htm. Доступ 28 июня 2021 г.