Когда мы говорим слово «балансировать», на ум приходит объект, который остается бесконечно долго. Однако это всего лишь один вид баланса, называемый «Статическое равновесие».
Также есть "динамическое равновесие". В нем, как следует из названия, нет ни одного момента, в котором рассматриваемый объект или явление оставались бы неподвижными. Например, чтобы вы поняли, посмотрите иллюстрацию ниже и обратите внимание, что количество воды, попадающей в контейнер, равно количеству, которое вытекает из него, при этом уровень воды остается постоянным. В этом случае мы говорим, что существует динамический баланс, баланс в движении.

Такой баланс возникает в обратимые реакции, то есть в тех реакциях, которые происходят в обоих направлениях. В то же время, когда молекулы реагентов превращаются в продукты, молекулы продуктов реагируют друг с другом с образованием реагентов. Обратимость реакции представлена стрелками в обоих направлениях:
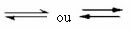
Когда скорость развития прямой реакции (образования продуктов) равна скорости развития обратная реакция (образование реагентов) при постоянной температуре означает, что реакция достигла своего равновесия. химический. А в случае реакций с присутствием только молекул в реагентах и продуктах мы имеем молекулярный баланс.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Ниже приведен пример реакции, которая происходит между газообразным водородом (H2) и газообразный йод (I2), для образования газообразного иодистого водорода (HI):
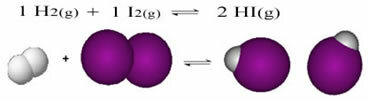
В начале реакции скорость развития прямой реакции была выше, ведь концентрация реагентов была максимальной, а продуктов - нулевой. Так что скорость развития обратной реакции тоже была нулевой.
Однако со временем газообразные водород и йод вступают в реакцию с образованием продукта. Таким образом, концентрация реагентов начинает уменьшаться и скорость их развития также снижается.
По мере увеличения концентрации продуктов и уменьшения концентрации реагентов скорость развития обратной реакции начинает увеличиваться. Если поддерживать постоянную температуру, наступит время, когда две скорости развития останутся одинаковыми, что покажет, что реакция достигла химического молекулярного равновесия.
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Молекулярный баланс»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm. Доступ 28 июня 2021 г.