Рассмотрим общую обратимую реакцию ниже, где строчные буквы соответствуют сбалансированным коэффициентам реакции, а верхние буквы - реагентам, а все продукты газообразны:

Рассматривая каждое из направлений реакций в отдельности, скорости их развития (Td) определяются как:
* Прямая реакция: aA + bB → cC + dD
Всенепосредственный = Kнепосредственный. [THE]В. [B]B
* Обратная реакция: cC + dD → aA + bB
Всеобратный = Kобеспечить регресс. [Ç]ç. [D]d
Константа химического равновесия с точки зрения концентрации в количестве вещества (Kç) и по парциальному давлению (Kп) будет получено делением Kнепосредственный автор: Kобеспечить регресс.
Итак, у нас есть:
Kнепосредственный. [THE]В. [B]B = 1 → Kнепосредственный__ = __[Ç]ç. [D]d___
Kобеспечить регресс. [Ç]ç. [D]d Kобеспечить регресс [THE]В. [B]B
Бытие, Kç =_Kнепосредственный_
Kобеспечить регресс
Итак, у нас есть:
Kç =__[Ç]ç. [D]d___ или Kп =__(Praça)ç. (пД)d___ |
Где p - парциальное давление каждого вещества в состоянии равновесия.
Таким образом, каждая концентрация повышается до показателя степени, соответствующего коэффициенту соответствующего вещества в реакции, и Kç не имеет единицы *.
Кроме того, следует выделить очень важный аспект: в этом выражениине должны быть представлены ни твердые компоненты, ни чистые жидкости., так как в этом выражении участвуют только те вещества, которые могут изменяться. Концентрация вещества в твердом состоянии постоянна и, таким образом, уже включена в само значение K.ç. То же самое и с чистыми жидкостями, такими как вода. Коротко, в выражении участвуют только вещества в газообразном состоянии и в водном растворе.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Обратите внимание на примеры ниже:
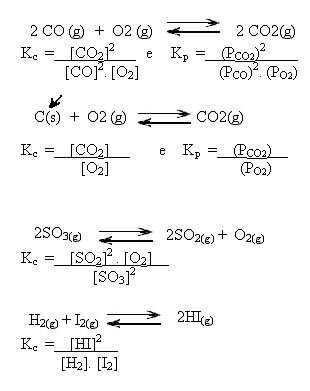
K значенияç может показать нам, одинаковы ли концентрации реагентов и продуктов или один из них больше другого:
- если Kç или Kп равна единице (Kç = 1), это означает, что концентрации реагентов и продуктов равны;
- если стоимость Kç или Kп быть высоким, это означает, что продукты находятся в большей концентрации, потому что в выражении Kç товары указаны в числителе;
- если стоимость Kç или Kп низкий, это означает, что реагенты находятся в более высокой концентрации, поскольку в выражении Kç реагенты указаны в знаменателе.
* Kç и Kп это безразмерные числа, то есть чистые числа, без единицы измерения, связанной с какой-либо величиной или соотношением между величинами.
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Константы равновесия Kc и Kp»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/constantes-equilibrio-kc-kp.htm. Доступ 28 июня 2021 г.