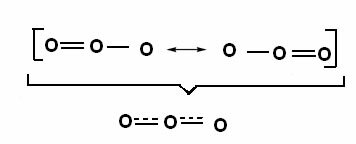
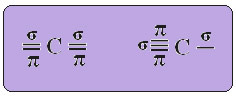
THE гибридизация углерода sp-типа это происходит только тогда, когда он создает две пи-связи (π) и две сигма-связи (σ). В этом случае есть две возможности: углерод может образовывать две двойные связи или одинарную и тройную связь, как показано ниже:
Текст "гибридизация sp-типа3”Подробно показывает, как происходит гибридизация углерода. Помните: гибридизация - это «смешение» чистых атомных орбиталей, которые создают гибридные атомные орбитали, эквивалентные друг другу, но отличные от исходных чистых орбиталей. Итак, это происходит в углеродных орбиталях, которые изначально были представлены следующим образом:
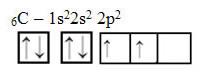
Однако с получением энергии электрон (обозначенный стрелкой) с орбитали 2s продвигается на орбиталь 2p:
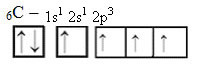
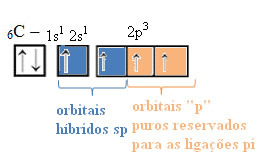
Таким образом, углерод имеет четыре неспаренных орбитали, способных образовывать четыре ковалентные связи, а не только две.
В случае гибридизации sp-типа мы знаем, что две связи будут пи; они происходят в чистых "p" -орбиталях, в то время как две другие орбитали, которые являются sp-гибридами, образуют оставшиеся сигма-связи.
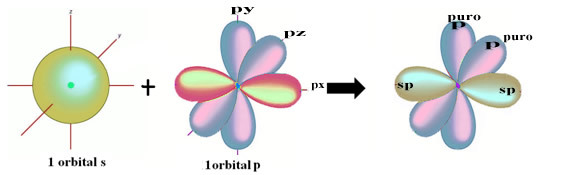
Пространственное представление этой гибридизации s- и p-орбиталей, дающей начало гибридной sp-орбитали, можно представить следующим образом:
Не останавливайся сейчас... После рекламы есть еще кое-что;)
На рисунке выше очень ясно, что есть две чистые орбитали, которые образуют пи-связи.
Чтобы вы поняли, как это происходит, давайте возьмем в качестве примера молекулу цианистого газа (HCN), которая используется в США в газовых камерах для заключенных, приговоренных к смертной казни. Его структурная формула определяется следующим образом:
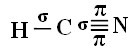
Что касается углерода, его атомные орбитали уже были показаны, теперь посмотрите на орбитали водорода и азота:
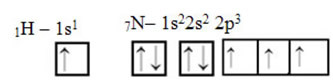
Обратите внимание, что неспаренная водородная орбиталь, которая будет выполнять сигма-связь, - это буква «s», которая пространственно представлена кружком; и азотные орбитали относятся к типу «p», представленному тремя двойными овоидами (каждый в пространственном поле: x, y, z). Таким образом, структура молекулы HCN представлена следующим образом:
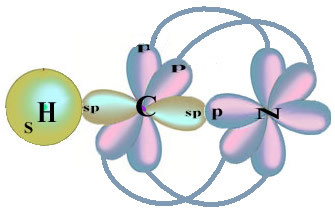
Что касается типа связей, существующих в этой структуре формальдегида, мы имеем:
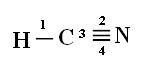
Подключения: 1 = σs-sp
2 = σp-sp
3 = 4 = πп-п
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Гибридизация Sp-типа»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm. Доступ 28 июня 2021 г.