Обратимые реакции обычно начинаются с определенного количества реагентов. Когда начинается прямая реакция, со временем эти реагенты расходуются на формирование продуктов, следовательно, концентрация реагентов уменьшается, в то время как концентрация продуктов увеличивается. Затем начинается обратная реакция, в которой также образуются реагенты, пока скорость развития (скорости) прямой и обратной реакций не останется той же самой, достигая так называемого химический баланс.
В состоянии равновесия существует константа равновесия Kc, которая в основном выражается следующим образом:
|
Kc = [продукты]коэффициент в сбалансированном химическом уравнении [реагенты]коэффициент в сбалансированном химическом уравнении |
То есть, учитывая следующую общую реакцию равновесия:
а A + b B ↔ c C + d D
Поскольку строчные буквы - это коэффициенты, а прописные - вещества, константа равновесия этой реакции будет:
Kc = [Ç]ç. [D]d
[THE]В. [B]B
Подробнее об этом можно прочитать в тексте. Константы равновесия Kc и Kp. Этот текст также показывает нам кое-что важное: значения Kc могут показать нам, насколько концентрация реагентов и продукты равны или если один больше другого и, как следствие, если химический баланс смещен в какую-то сторону реакция.
Итак, нам нужно определить значение Kc. Для этого помните, что эти расчеты являются экспериментальными, поэтому давайте рассмотрим некоторые примеры реакций и данные, полученные на их основе.
Что-то, что очень полезно при выполнении этих вычислений, - это написать таблицу, аналогичную приведенной ниже, и выполнить шаги, упомянутые в ней:

Таблица для организации данных, используемых для расчета константы равновесия
А теперь перейдем к практике:
Пример 1: В закрытой емкости объемом 2 л при температуре 100 ° C находится 20 моль N2О4. Начинает протекать следующая обратимая реакция: N2О4 ↔ НЕТ2. Через некоторое время было обнаружено, что реакция достигла химического равновесия и что 8 моль NO2 сформировался. Какое значение имеет константа равновесия Kc при температуре 100 ° C?
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Разрешение:
Воспользуемся таблицей:

Таблица, используемая для решения примера расчета константы равновесия
Обратите внимание, что в строке, где были написаны количества, которые вступают в реакцию и образуются, мы знаем, что было потрачено 4 моля азота.2О4, потому что соотношение составляет 1: 2, и что 8 моль NO образовалось2.
Теперь просто заменим значения, найденные в выражении константы равновесия Kc этой реакции:
Kc = [НА2]2
[N2О4]
Kc = (4 моль / л) 2
(8 моль / л)
Kc = 2 моль / л
Значение Kc безразмерно, у него нет единиц измерения, связанных с какой-либо величиной.
Теперь давайте посмотрим на пример, который также содержит товары с самого начала:
Пример 2: В закрытом контейнере емкостью 5 л при температуре T находятся 2 моля газообразного водорода, 3 моля газообразного йода и 4 моля иодистого водорода. Реакция переходит в химическое равновесие при температуре T, и оказывается, что в сосуде находится 1 моль газообразного водорода. Какой график представляет это равновесие и каково значение константы равновесия Kc при температуре T?
Разрешение:
Используя таблицу:
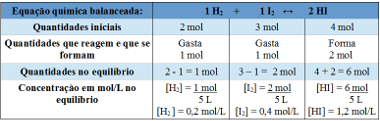
Таблица, используемая для определения константы равновесия
График, показывающий изменения концентраций реагентов и продуктов в моль / л до тех пор, пока они не достигнут равновесия, может быть представлен следующим образом:

График химического равновесия, показывающий изменения концентраций реагентов и продуктов
Теперь находим значение константы равновесия:
Kc = __ [HI]2__
[ЧАС2 ]. [Я2]
Kc = (1,2)2
0,2. 0,4
Кс = 18
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Расчет константы равновесия Kc»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm. Доступ 28 июня 2021 г.
Химия

Проверьте свои знания и узнайте больше с этим списком решенных упражнений на химические весы. Благодаря этому материалу вы сможете лучше понять, как работают константы равновесия (Kp, Kc и Ki), сдвиг равновесия, pH и pOH, а также равновесие в так называемых буферных растворах.