Электролиз - это несамопроизвольная химическая реакция который включает окислительно-восстановительную реакцию, которая вызывается электрическим током.
Чтобы электролиз происходил, электрический ток должен быть непрерывным и иметь достаточное напряжение.
Чтобы участвующие ионы имели свободу в движении, которое они выполняют, электролиз может происходить путем плавления (магматический электролиз) или растворения (электролиз в растворе).
Применение электролиза
В процессе электролиза производятся многие материалы и химические соединения, например:
- алюминий и медь
- водород а также хлор в цилиндре
- бижутерия (процесс гальваники)
- скороварка
- магниевые колеса (колпаки автомобилей).
Законы электролиза
Законы электролиза были разработаны английским физиком и химиком Майклом де Фарадеем (1791-1867). Оба закона регулируют количественные аспекты электролиза.
THE первый закон электролиза имеет следующее утверждение:
“Масса элемента, отложившегося в процессе электролиза, прямо пропорциональна количеству электричества, которое проходит через электролитическую ячейку.”.
Q = я. т
Где,
Q: электрический заряд (Кл)
я: сила электрического тока (А)
т: временной интервал прохождения электрического тока (с)
THE второй закон электролиза имеет следующее утверждение:
“Масса различных элементов, осаждаемых во время электролиза одним и тем же количеством электричества, прямо пропорциональна их химическим эквивалентам.”.
М = К. А ТАКЖЕ
Где,
M: масса вещества
K: константа пропорциональности
А ТАКЖЕ: грамм-эквивалент вещества
Подробнее читайте в статье: Постоянная Фарадея.
Классификация
Процесс электролиза может происходить путем плавления или растворения:
Магматический электролиз
Магматический электролиз - это электролиз, который производится из расплавленного электролита, то есть в процессе Слияние.
В качестве примера возьмем NaCl (хлорид натрия). Когда мы нагреваем вещество до 808 ° C, оно плавится и присутствующие ионы (Na+ и Cl-) в жидком состоянии начинают иметь большую свободу передвижения.
когда электрический ток переходит в электролитическую ячейку, катионы Na+ их притягивает отрицательный полюс, называемый катодом. Уже анионы Cl-, притягиваются к положительному полюсу или аноду.
В случае Na+ происходит реакция восстановления, а в Cl-, есть реакция окисление.
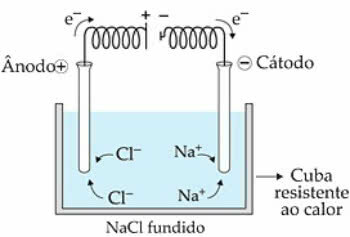
Схема электролиза магматического NaCl
Водный электролиз
При водном электролизе в качестве ионизирующего растворителя используется вода. В водном растворе электролиз можно проводить с помощью перевернутых электродов или активных (или реактивных) электродов.
Инертные электроды: вода в растворе ионизируется в соответствии с уравнением:
ЧАС2O ↔ H+ + ОН-
С диссоциация NaCl имеем:
NaCl → Na+ + Cl-
Таким образом, катионы H+ и дальше+ могут разряжаться на отрицательном полюсе, а анионы ОН- и Cl- может разряжаться на положительном полюсе.
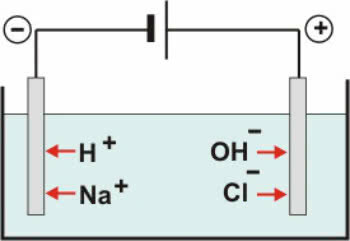
Схема водного электролиза NaCl
В катионах идет реакция восстановления (катодное восстановление), а в анионах - реакция окисления (анодное окисление).
Итак, у нас есть реакция электролиза:
2 NaCl + 2 Н2O → 2 дюйма+ + 2 ОН- + H2 + Cl2
Отсюда можно сделать вывод, что молекулы NaOH остаются в растворе, а H2 выпускается на отрицательном полюсе, и Cl2, на положительном полюсе.
Этот процесс приведет к эквивалентному уравнению:
2 NaCl + 2 Н2О → 2 NaOH + Н2 + Cl2
Активные электроды: в этом случае активные электроды участвуют в электролизе, однако они подвержены коррозии.
В качестве примера приведем электролиз в водном растворе сульфата меди (CuSO4):
CUSO4 → Cu2 + ОС 2-4
ЧАС2O → H+ + ОН-
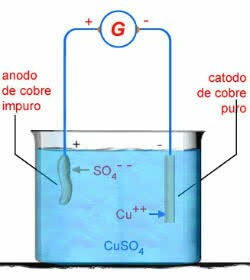 Схема водного электролиза CuSO4
Схема водного электролиза CuSO4
В этом случае медный анод подвергнется коррозии:
Жопа0 → Cu2+ + 2e-
Это связано с тем, что, согласно стандартным потенциалам электродов, электрическому току легче удалить электроны из Cu.0 чем ОС 2-4 или из ох-.
Следовательно, на отрицательном полюсе происходит следующая реакция электролиза:
2e- + Cu2+ → Cu
На положительном полюсе происходит реакция электролиза:
Cu → Cu2+ + 2e-
Наконец, когда мы складываем два уравнения электролиза, в результате получаем ноль.
Хотите узнать больше по теме? Прочтите статьи:
- Ион, катион и анион
- Химические реакции
- окислительно-восстановительные реакции
Аккумулятор и электролиз
Электролиз основан на явлении, обратном аккумулятору. При электролизе процесс не является самопроизвольным, как в батареях. Другими словами, электролиз преобразует электрическую энергию в химическую энергию, а клетка вырабатывает электрическую энергию из химической энергии.
узнать больше о Электрохимия.
Упражнения
1. (Ulbra-RS) Металлический калий можно получить путем электролиза хлорида калия в процессе горения. Отметьте в этом утверждении правильный вариант.
а) Электролиз - это процесс, который включает реакции окисления-восстановления и восстановления, вызванные электрическим током.
б) Магматический электролиз хлорида калия происходит при комнатной температуре.
в) Калий встречается в природе в восстановленной форме (K0).
г) Реакция электролиза - это реакция, протекающая с помощью ультрафиолетового излучения.
д) В процессе электролиза хлорида калия для получения металлического калия происходит перенос электронов от калия к хлору.
Альтернативой
2. (УФРГС-РС) В катоде электролизера всегда:
а) Осаждение металла.
б) Полуреакция восстановления.
в) Производство электрического тока.
г) выделение газообразного водорода.
д) Химическая коррозия.
Альтернатива б
3. (Unifor-CE) К электролизу относятся следующие предложения:
Я. Реакции электролиза происходят с расходом электроэнергии.
II. Водные растворы глюкозы нельзя подвергнуть электролизу, потому что они не проводят электрический ток.
III. При электролизе солевых растворов катионы металлов подвергаются окислению.
Можно сказать только:
а) Я прав.
б) II правильно.
в) III верно.
г) I и II верны.
д) II и III верны.
Альтернатива
4. (FEI-SP) Два студента-химика провели электролиз BaCl2; первый водянистый, второй огненный. Что касается результата, можно сказать, что оба получили:
а) H2 это2 на анодах.
б) H2 и Ba на анодах.
в) Cl2 и Ba на электродах.
г) H2 на катодах.
д) Cl2 на анодах.
Альтернатива и
5. (Vunesp) "Бассейн без химии»- реклама, связанная с очисткой воды. Однако известно, что лечение заключается в добавлении в воду хлорида натрия и пропускании этого вода через емкость, снабженную медным и платиновым электродами, подключенными к проводу машина.
а) Основываясь на этой информации, обсудите правильность рекламного сообщения.
б) Учитывая инертные электроды, напишите уравнения участвующих реакций, которые подтверждают предыдущий ответ.
а) Рекламное сообщение неверно, так как будет образование химических продуктов.
б) 2 NaCl + 2H2О → 2 NaOH + Н2 + Cl2 (реакция с образованием хлора, полезная при очистке воды в бассейне)
2 NaOH + Cl2 → NaCl + NaClO + H2O (реакция с образованием сильного бактерицида NaClO)



