O echilibrarea unei ecuații de oxidare-reducere se bazează pe egalitatea numărului de electroni dați cu numărul de electroni primiți. O metodă simplă de realizare a acestei echilibrări este dată de următorii pași:
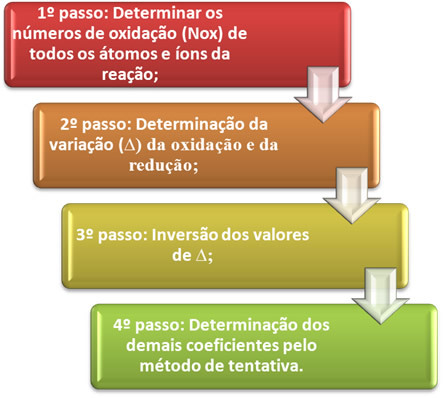
Să vedem în practică cum să aplicăm acești pași, prin următorul exemplu:
Reacția dintre o soluție apoasă de permanganat de potasiu și acid clorhidric:
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*Primul pas:Determinați numerele de oxidare:
Acest pas este important, deoarece de obicei nu putem vizualiza rapid ce specii suferă oxidare și reducere.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*Al doilea pas:Determinarea variației de oxidare și reducere:

Rețineți că manganul (Mn) este redus și clorul (Cl) este oxidat.
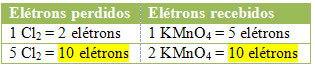
MnCl2 = ∆No = 5
Cl2 = ∆No = 2
În cazul clorului, putem observa că HCl a dat naștere la 3 compuși (KCl, MnCl2și Cl2), dar ceea ce ne interesează este Cl2, pentru că Noxul tău a suferit variații. Fiecare clor care formează Cl2 pierde 1 electron; întrucât este nevoie de 2 clori pentru a forma fiecare Cl2, atunci se pierd doi electroni.
Pasul 3:Inversia valorilor ∆:
În acest pas, valorile lui ∆ sunt schimbate între speciile menționate, devenind coeficienții lor:
MnCl2 = ∆Nox = 5 → 5 va fi coeficientul Cl2
Cl2 = ∆Nox = 2→ 2 va fi coeficientul de MnCl2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
În acest moment, este deja posibil să se cunoască doi coeficienți ai ecuației.
Observare: în mod normal, în majoritatea reacțiilor, această inversare a valorilor se realizează pe primul membru. Dar, ca regulă generală, acest lucru ar trebui făcut în membrul care are cel mai mare număr de atomi care suferă redox. Dacă acest criteriu nu poate fi îndeplinit, inversăm valorile pentru membrul cu cel mai mare număr de specii chimice. Așa s-a făcut aici, deoarece al doilea membru are mai multe substanțe.
Pasul 4: Echilibrarea procesului:
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Deoarece în cel de-al doilea membru există doi atomi de mangan, așa cum arată coeficientul, în primul trebuie să existe și. Deci avem:
2 kmnO4 + HCI → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Astfel, cantitatea de potasiu (K) din primul membru a fost 2, care va fi același coeficient pentru acest atom în al doilea membru:
2 kmnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- Cantitatea de clor (Cl) din al doilea membru este de 16 în total, deci coeficientul de HCl al primului membru va fi:
2 kmnO4 + 16 HCI → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- Numărul de hidrogeni din primul membru este 16, deci coeficientul de apă (H2O) al celui de-al doilea membru va fi egal cu 8, deoarece înmulțirea indicelui de hidrogen (2) cu 8 este egală cu 16:
2 kmnO4 + 16 HCI → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
- Pentru a verifica dacă ecuația este corect echilibrată putem vedea două criterii:
1) Verificați dacă cantitatea fiecărui atom din cei doi membri este egală:
2 kmnO4 + 16 HCI →2 KCI + 2 MnCl2 + 5 Cl2 + 8 ore2O
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2) Vedeți dacă numărul total de electroni pierduți este egal cu numărul total de electroni primiți:
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm
