Pentru a avea loc o reacție chimică, este necesar să îndeplinim patru condiții de bază, care sunt:
1. Reactivii trebuie să contacteze;
2. Trebuie să existe o afinitate chimică între reactivi;
3. Coliziunile dintre particulele de reactiv trebuie să fie eficiente;
4. Trebuie atinsă energia de activare.
Vedeți pe scurt fiecare caz:
1.Contactul dintre reactivi:
Această condiție este evidentă, deoarece chiar dacă reactanții au multă afinitate unul pentru celălalt, ca în cazul acizilor și bazelor, dacă sunt separați, reacția nu va avea loc. Aceștia trebuie să ia contact astfel încât particulele lor să se poată ciocni, rupând legăturile reactanților și formând legăturile produselor.

2.Afinitate chimică:
După cum am văzut, aducerea reactivilor în contact este necesară, dar nu suficientă. De exemplu, dacă punem sodiul în contact cu apa, va apărea o reacție extrem de violentă, dar dacă punem aur, nu vom vedea nicio diferență. Acest lucru se datorează faptului că diferite substanțe au afinități chimice diferite între ele sau este posibil să nu aibă deloc afinitate. Cu cât afinitatea chimică este mai mare, cu atât reacția este mai rapidă.
În exemplele menționate, sodiul are o mare afinitate cu apa, atât de mult încât, pentru a nu intra în contact cu umiditatea din aer, sodiul metalic este stocat în kerosen. Aurul este inert, motiv pentru care monumentele de aur durează atât de mult, precum sarcofagele din Egipt.

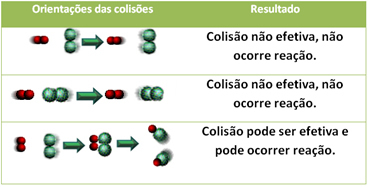
3.Teoria coliziunilor:
Chiar și în compușii care au afinitate chimică, pentru ca reacția să aibă loc este necesar ca particulele, atomii sau moleculele lor să se ciocnească eficient. Nu toate particulele care se ciocnesc fac acest lucru eficient, ci șocurile care duc la ruperea legăturile reactive și formarea de noi legături sunt cele care apar în orientarea corectă și cu energia suficient.
Mai jos este cazul a două coliziuni ineficiente și a unei coliziuni eficiente care are ca rezultat reacția.
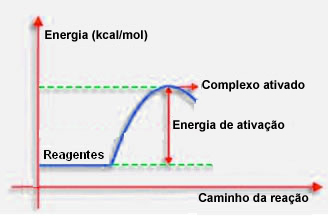
4.Energie de activare și complex activat:
După cum sa menționat în articolul anterior, o coliziune efectivă, pe lângă îndrumarea favorabilă, are nevoie de energie suficientă. Cantitatea minimă de energie necesară pentru ca fiecare reacție să aibă loc se numește energie de activare.
Dacă reactanții au o energie egală sau mai mare decât energia de activare, în timpul șocului bine orientat, se va forma un complex activat inițial, care este o structură intermediară între reactanți și produse. În complexul activat, există legături de reactivi slăbiți și se formează legături de produse noi.
Astfel, energia de activare funcționează ca un fel de barieră pentru ca reacția să se producă, deoarece cu cât este mai mare, cu atât va fi mai dificil să se producă reacția. În unele cazuri, este necesar să se furnizeze energie reactivilor. De exemplu, gazul de gătit are o afinitate de a interacționa cu oxigenul din aer, dar trebuie să furnizăm energie atunci când aducem chibritul, altfel reacția nu are loc. Dar, odată ce a început, reacția în sine eliberează suficientă energie pentru a activa celelalte molecule și pentru a menține reacția.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm


