THE geometrie unghiulară este unul dintre mai multe tipuri de geometrie moleculară, care poate fi încă liniar, piramidal, trigonal plat, tetraedrică, etc. Geometria unghiulară poate fi găsită numai în molecule care au următoarele caracteristici:
Triatomica, adică au doar trei atomi;
Au cel puțin trei nori de electroni în atomul central.
Notă: norul electronic este tot legătură covalentă (simplu, dublu, triplu sau coordonat) între atomi și perechi de electroni ai stratul de valență care nu participă la un apel.
Vedeți câteva exemple de molecule care au geometrie unghiulară:
Primul exemplu: apă (H2O)

structura convențională a apei
În structura apei, avem:
Trei atomi: doi hidrogeni și un oxigen;
Oxigenul este atomul central deoarece face un număr mai mare de legături (două, deoarece aparține familiei VIA);
Două legături simple între oxigen și hidrogeni. Acest lucru se datorează faptului că fiecare hidrogen poate face doar o legătură și oxigenul două legături;
Patru electroni fără legătură în oxigen, deoarece are șase electroni în învelișul de valență și folosește doar doi în legături.
Prin urmare, ca și în molecula de apă, există trei atomi și patru nori electronici (două legături simple și două perechi de electroni fără legătură) în atomul central, geometria este unghiulară.
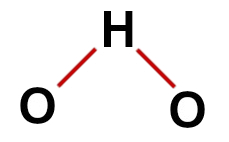
Formula structurală corectă a apei
Notă: Ori de câte ori molecula prezintă aceste tipare, unghiul format între atomi este de aproximativ 109º 28'.
Al 2-lea exemplu: Dioxid de sulf (SO2)

Structura convențională a dioxidului de sulf
În structura dioxidului de sulf, avem:
Trei atomi: doi oxigeni și un atom de sulf;
Sulful este atomul central, deoarece este cel mai mic element din moleculă, deoarece toate elementele trebuie să facă același număr de legături (două);
O dublă legătură între sulf și unul dintre oxigeni. Asta pentru că ambele au nevoie de două conexiuni;
unu legătură covalentă coordonată sau dativă, deoarece sulful a fost stabil după efectuarea împerecherii cu celălalt oxigen, dar există încă un atom de oxigen care are nevoie de doi electroni;
Patru electroni care nu se leagă în oxigen. Asta pentru că oxigenul are șase electroni în coaja de valență și folosește doar doi în legături.
Astfel, ca și în molecula de dioxid de sulf, există trei atomi și patru nori electronici (două legături simple și două perechi de electroni fără legătură) în atomul central, geometria este unghiulară.
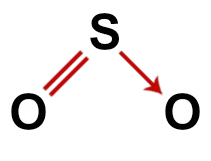
Formula structurală corectă a dioxidului de sulf
Notă: Ori de câte ori molecula are aceste tipare, unghiul format între atomi este de aproximativ 120O.
De mine. Diogo Lopes Dias
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm