O soluție este un amestec omogen de două sau mai multe substanțe.. Ca, de exemplu, o soluție de sare (solut) dizolvată în apă (solvent).

În special în laboratoarele și industriile chimice, acest proces este foarte important, deoarece chimistul trebuie să pregătească soluții cu concentrații cunoscute. Mai mult, în activități experimentale, sunt utilizate soluții cu concentrații foarte mici, astfel încât o probă din soluția concentrată este diluată la concentrația dorită.
În fiecare zi, de mai multe ori, chiar fără să ne dăm seama, realizăm procesul de diluare a soluțiilor. De exemplu, ambalarea produselor de curățat și de igienă casnică, precum dezinfectanții, recomandă diluarea acestora înainte de utilizare. Unii producători sugerează pe etichetele produsului să fie diluat cu apă în proporție de 1 până la 3, adică pentru fiecare parte a produsului trebuie adăugate 3 părți de apă. Acest lucru se face deoarece produsul este foarte concentrat și puternic și poate deteriora locul unde va fi aplicat dacă nu este diluat în mod corect. Pe de altă parte, dacă îl diluați mai mult decât ar trebui, puteți pierde bani, deoarece produsul nu va obține rezultatul dorit.

Un alt exemplu este atunci când facem sucuri. Etichetele multor concentrate de suc indică faptul că un pahar de suc trebuie diluat sau amestecat cu 5 pahare de apă. Astfel, sucul devine „mai slab”, adică mai puțin concentrat.
Imaginați-vă că ați diluat un astfel de suc în 3 L de apă. Dacă concentrația inițială a sucului a fost de 40g / L, înseamnă că a avut o masă de 40g pentru fiecare litru de solvent. Dar, deoarece vom avea 3 L, masa va fi împărțită la 3 și concentrația va fi apoi de aproximativ 13, 33 g / L sau 13 grame pentru fiecare litru de soluție. Cu toate acestea, în întreaga soluție, masa solutului de 40 g rămâne în continuare.
Calculul acestei noi concentrații se poate face după cum urmează:
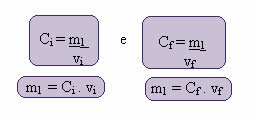
Unde indicii i și f reprezintă, respectiv, valorile inițiale și finale. Deoarece valoarea lui m1 nu s-a schimbat, putem egaliza ecuațiile:
Çeu. veu = Cf. vf
Înlocuind valorile pe care le avem, conform exemplului anterior, rețineți:
Soluția inițială:
Çeu: 40g / L
m1: 40g
veu: 1L
Soluție finală:
Çf: ?
m1: 40g
vf: 3L
Çeu. veu = Cf. vf
(40 g / L). (1 L) = Cf. 3L
Çf = 40 g / L
3
Çf = 13,333 g / L
Același raționament este valabil și pentru concentrația molară (M) și pentru procentajul în masă de dizolvat sau titru (T):
Meu. veu = Mf. vf și Teu. veu = Tf. vf
De Jennifer Fogaça
Absolvent în chimie
Echipa școlii din Brazilia
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm



