Soluție tampon este un amestec omogen care nu modifică pH-ul sau pOH atunci când la acest amestec se adaugă cantități mici de acid tare sau bază tare. Cu toate acestea, amestecul nu modifică pH-ul sau pOH doar dacă prezintă una dintre cele două compoziții de mai jos:
Priza acid (pH mai mic de 7):
Are acid slab amestecat cu a sare solubil care are același anion, cum ar fi acidul cianhidric (HCN) și cianura de potasiu (KCN), care au același anion cianur (CN).
Tampon de bază (pH mai mare de 7):
Baza slab amestecat cu o sare care are același cation, cum ar fi hidroxidul de zinc [Zn(OH)2] și clorură de zinc (ZnCl2), care au același cation de zinc (Zn+2).
Este important, pentru a înțelege influența pe care o are o soluție tampon asupra primirii unui acid sau a unei baze puternice, să ne amintim când acizii și bazele sunt considerați puternici:
→ Clasamentul bazelor din punct de vedere al forței
puternic: baze cu elemente chimice din familiile IA (metale alcaline) și IIA (metale alcalino-pământoase), cu excepția magneziului;
slab: baze care au elementul magneziu si altul, atata timp cat nu apartine familiilor IA si IIA.
→ Clasificarea acid pentru putere
a) Pentru hidrați (acizi fără oxigen):
puternic: numai HCl, HBr si HI;
moderată: numai HF;
slab: orice alt hidroxid.
b) Pentru oxiacizi (acizi cu oxigen):
puternic: când scăderea numărului de oxigeni cu numărul de hidrogeni este egală sau mai mare de 2;
moderată: când scăderea numărului de oxigeni cu numărul de hidrogeni este egală cu 1;
slab: când scăderea numărului de oxigeni cu numărul de hidrogeni este egală sau mai mică de 0.
Influența adăugării unei baze puternice la un tampon
Pentru a explica, să folosim soluție tampon format din hidroxid de zinc [Zn(OH)2] și sarea solubilă a clorurii de zinc (ZnCl2), care va primi o cantitate mică de bază puternică hidroxid de sodiu (NaOH). Vedeți soldurile prezente în această soluție tampon:
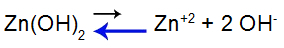
Ecuația de echilibru de disociere a bazelor
Echilibrul se deplasează spre stânga deoarece baza este slabă.
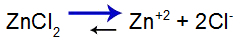
Ecuația de echilibru de disociere a sării
Echilibrul se deplasează spre dreapta deoarece sarea este solubilă.
Baza puternică are următorul echilibru:
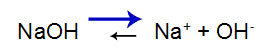
Ecuația de echilibru de disociere a bazelor
Echilibrul se deplasează spre dreapta deoarece baza este puternică.
Baza puternică adăugată eliberează anionul hidroxid (OH) în apă-), care are o mare afinitate pentru cationii de zinc (Zn+2) din sarea din al doilea echilibru. Asocierea dintre hidroxid și zinc formează hidroxid de zinc:
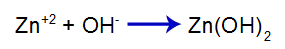
ecuația de formare a bazei
Deci OH- de bază scade cantitatea de zinc în al doilea echilibru și crește cantitatea de bază [Zn(OH)2], determinând-o să se disocieze în continuare și să elibereze cationi de Zn+2 în primul echilibru. Deoarece nu vom avea o modificare a cantității de hidroxid din mediu, prin urmare, pH-ul nu se schimbă.
Influența adăugării unui acid puternic într-un tampon
Pentru a explica, să folosim tamponul format din hidroxid de zinc [Zn(OH)2] și de sarea solubilă a clorurii de zinc (ZnCl2), care va primi o cantitate mică de acid iodhidric (HI), care este puternic. Vezi soldurile prezente în capac:
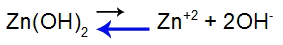
Ecuația de echilibru de disociere a bazelor
Echilibrul s-a deplasat spre stânga deoarece baza este slabă.
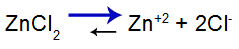
ecuația echilibrului de sare
Echilibrul s-a deplasat spre dreapta deoarece sarea este solubilă.
Acidul puternic are următorul echilibru:
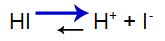
Ecuația echilibrului acidului
Echilibrul s-a deplasat spre dreapta deoarece acidul este puternic.
Acidul adăugat produce cationul hidroniu în apă (H+), care are o afinitate mare pentru ionii de hidroxid (OH-) de la bază. Asocierea dintre hidroniu și hidroxid formează o moleculă de apă:
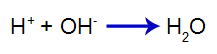
ecuația de formare a apei
Deci H+ de acid scade cantitatea de hidroxizi din primul echilibru, crescand disocierea bazelor. Deoarece nu vom avea o modificare a cantității de hidroxid din mediu, prin urmare, pH-ul nu se schimbă.
De mine. Diogo Lopes Dias
Sursă: Brazilia școală - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-solucao-tampao.htm
