Electroliză este un proces fizico-chimic care utilizează energie electrică din orice sursă (cum ar fi baterie sau baterie) pentru a forța apariția unei reacții chimice pentru a produce substanțe simple sau compozite care nu pot fi găsite în natură sau care nu se găsesc în cantități mari.
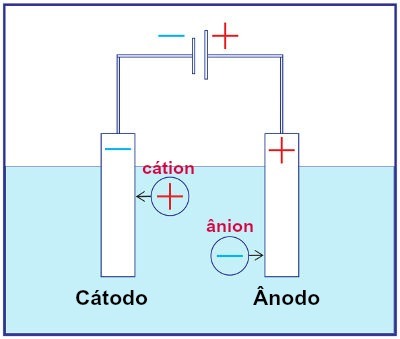
Reprezentarea ansamblului oricărui sistem de electroliză
În timpul electrolizei, un cation suferă o reducere la catod, iar un anion suferă o oxidare la anod. Acest lucru se întâmplă prin descărcarea electrică furnizată de o sursă externă. Astfel, în electroliză, avem o reacție non-spontană de oxidare și reducere.
Acum înțelegeți cele două moduri în care apare electroliza:
În acest tip de electroliză, folosim un substanță ionică în stare lichidă într-o cuvă electrolitică. Când substanța ionică (XY) suferă fuziune, aceasta suferă procesul de disociere, așa cum este reprezentat mai jos:
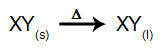

Apoi, când sursa de alimentare este pornită, cationul (X+) se deplasează spre catod, iar anionii (Y-) se deplasează spre anod. Astfel:
La catod: cationii primesc electroni (suferă reduceri) și se transformă într-o substanță stabilă (X), proces reprezentat de următoarea ecuație:
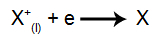
La anod: anionii pierd electroni (suferă oxidare) și devin o substanță stabilă (X), proces reprezentat de următoarea ecuație:

a) Exemplu de electroliză magmatică
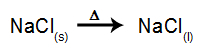
Ca un exemplu, urmați acum electroliza magmatică a clorura de sodiu (NaCI). Când clorura de sodiu (NaCI) suferă fuziune, aceasta suferă procesul de disociere, după cum se arată mai jos:
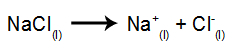
Apoi, când sursa de alimentare este pornită, cationul (Na+) se deplasează spre catod, iar anionii (Cl-) se deplasează spre anod. Astfel:
La catod: cationii din+ primesc electroni (suferă reducere) și devin o substanță stabilă (Na, care este un metal solid), proces reprezentat de ecuația de mai jos:

La anod: anionii Cl- pierd electroni (suferă oxidare) și devin o substanță stabilă (Cl2, care este gazos), proces reprezentat de ecuația de mai jos:

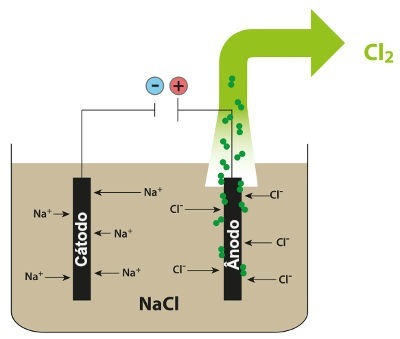
Schema care demonstrează electroliza magmatică a NaCl
Astfel, în electroliza magmatică a clorurii de sodiu, avem formarea de sodiu metalic (Na) și clor gazos (Cl2).
În acest tip de electroliză, folosim o substanță ionică dizolvată în apă, în interiorul rezervorului electrolitic. Deci, înainte de a efectua electroliza, mai întâi amestecăm substanța (de obicei o sare anorganice) în apă pentru a provoca disocierea acesteia (eliberarea unui cation și a unui anion), așa cum se arată muget:
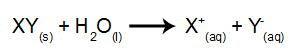
Diferența în raport cu electroliza igneo este că, pe lângă ionii din disociere, avem și ioni din auto-ionizarea apei. În auto-ionizarea sa, apa produce un cation hidroniu (H+) și un anion hidroxid (OH-), ca în ecuația de mai jos:

Astfel, în interiorul cuvei electrolitice avem prezența a doi cationi (unul din substanță ionic și unul din apă) și doi anioni (unul din substanța ionică și celălalt din Apă).
Pentru a ști care cation se va muta către catod și ce anion se va muta către anod, este necesar să cunoaștem ordinea de descărcare a cationilor și a anionilor.
Pentru cationi:
Au> Pt> Hg> Ag> Cu> Ni> Cd> Pb> Fe> Zn> Mn> hidroniu> Familia IIIA> Familia IIA> Familia IA
pentru anioni
Anioni neoxigenati si HSO4 > hidroxid> anioni oxigenati si F
Apoi, când sursa de alimentare este pornită, un cation (X+) se deplasează spre catod și unul dintre anioni (Y-) se deplasează spre anod.
La catod: cationii primesc electroni (suferă reducere) și se transformă într-o substanță stabilă (X), proces reprezentat de ecuația de mai jos:

La anod: anionii pierd electroni (suferă oxidare) și devin o substanță stabilă (Y), proces reprezentat de ecuația de mai jos:
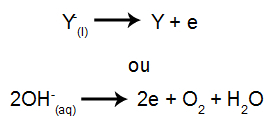
a) Exemplu de electroliză apoasă
De exemplu, vom folosi electroliza apoasă a clorurii de sodiu (NaCI). Când clorura de sodiu (NaCI) este dizolvată în apă, aceasta suferă procesul de disociere, după cum se arată mai jos:
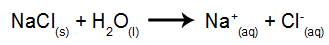
Pe lângă disocierea NaCl, avem auto-ionizarea apei:

Deci avem cationii H.+ și pe+ și anionii OH- și Cl-. Apoi, când sursa de alimentare este pornită, avem următoarele:
la catod: cationii H.+ primesc electroni (reduși) și devin o substanță stabilă (H2, care este un gaz). Acest lucru se datorează faptului că hidroniul are prioritate de descărcare asupra elementelor familiei IA (în acest caz, Na). Procesul este reprezentat de ecuația de mai jos:
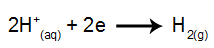
la anod: anionii Cl- pierd electroni (suferă oxidare) și devin o substanță stabilă (Cl2, care este gazos). Acest lucru se datorează faptului că Cl- este un anion neoxigenat și are prioritate de descărcare față de hidroxid, proces reprezentat de ecuația de mai jos:


Schema care demonstrează electroliza apoasă a NaCl
Astfel, în electroliza apoasă a clorurii de sodiu, avem formarea hidrogenului gazos (H2) și clor gazos (Cl2).
De mine. Diogo Lopes Dias
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletrolise.htm
