Tabelul periodic este un instrument important de studiu care colectează informații despre toate elementele chimice cunoscute.
Testați-vă cunoștințele cu această listă de 17 întrebări cu diferitele abordări pe această temă și rezolvați-vă îndoielile cu rezoluțiile comentate după feedback.
Pentru a ajuta la înțelegerea întrebărilor, utilizați tabelul periodic completă și actualizată.
Organizarea tabelului periodic
intrebarea 1
(UFU) La începutul secolului al XIX-lea, odată cu descoperirea și izolarea diferitelor elemente chimice, a devenit necesară clasificarea lor rațională, pentru a efectua studii sistematice. Au fost adăugate multe contribuții până la atingerea clasificării periodice actuale a elementelor chimice. În ceea ce privește clasificarea periodică actuală, răspundeți:
a) Cum sunt elementele enumerate secvențial în tabelul periodic?
Tabelul periodic este organizat în secvențe de elemente chimice în ordine crescătoare de numar atomic. Acest număr corespunde numărului de protoni din nucleul atomului.
Această metodă de organizare a fost propusă de Henry Moseley când a reconfigurat masa propusă de Dmitri Mendeleiev.
Un element poate fi localizat în tabel după familia și perioada în care este inserat. Această distribuție are loc după cum urmează:
| grupuri sau familii | 18 secvențe verticale |
| Grupuri de elemente care au caracteristici similare. |
| Perioade | 7 secvențe orizontale |
| Numărul de straturi electronice pe care le are elementul. |
b) Ce grupuri din tabelul periodic pot fi găsite: un halogen, un metal alcalin, un metal alcalin pământos, un calcogen și un gaz nobil?
Clasificarea elementelor în grupuri se face în funcție de proprietăți. Elementele care se află în același grup au caracteristici similare și pentru clasificările date trebuie să:
| Clasificare | grup | Familie | Elemente |
| halogen | 17 | 7A | F, Cl, Br, I, At și Ts |
| metal alcalin | 1 | 1A | Li, Na, K, Rb, Cs și Fr |
| metal alcalin pământos | 2 | 2A | Fii, Mg, Ca, Sr, Ba și Ra |
| calcogen | 16 | 6A | O, S, Se, Te, Po și Lv |
| gaz nobil | 18 | 8A | El, Ne, Ar, Kr, Xe, Rn și Og |
intrebarea 2
(PUC-SP) Rezolvați problema pe baza analizei afirmațiilor de mai jos.
I - Tabelul periodic actual este dispus în ordine crescătoare a masei atomice.
II - Toate elementele care au 1 electron și 2 electroni în învelișul de valență sunt, respectiv, metale alcaline și metale alcalino-pământoase, cu condiția ca numărul cuantic principal a acestui strat (n 1).
III - În aceeași perioadă, elementele prezintă același număr de niveluri (straturi).
IV - În același grup (familie), elementele au același număr de niveluri (straturi).
Se concluzionează că, în ceea ce privește tabelul periodic actual al elementelor chimice, acestea sunt corecte:
a) I și IV (numai).
b) I și II (numai).
c) II și III (numai).
d) II și IV (numai).
e) III și IV (numai).
Alternativă corectă: c) II și III (numai).
Analizând fiecare alternativă trebuie să:
AM GRESIT. Elementele sunt aranjate în ordine crescătoare a numărului atomic.
II - CORECT. Electronii din carcasa de valență definesc grupul în care se află elementul.
| Metale alcaline | 1 electron în învelișul de valență |
| 3citit | 2-1 |
| 11La | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Pr | 2-8-18-32-18-8-1 |
| metale alcalino-pământoase | 2 electroni în carcasa de valență |
| 4fi | 2-2 |
| 12mg | 2-8-2 |
| 20Aici | 2-8-8-2 |
| 38Domnul | 2-8-18-8-2 |
| 56Ba | 2-8-18-18-8-2 |
| 88Broască | 2-8-18-32-18-8-2 |
Numărul cuantic principal corespunde cochiliei în care este situat electronul, fiind diferit de 1 deoarece prin distribuția electronică observăm că locația electronului este de la a doua coajă sau n = 2.
III - CORECT. Amplasarea unui element într-o anumită perioadă se datorează numărului de straturi la efectuarea distribuției electronice.
| Perioade | 7 secvențe orizontale |
| Prima perioadă | 1 strat: K |
| A 2-a perioadă | 2 straturi: K, L |
| A 3-a perioadă | 3 straturi: K, L, M |
| A 4-a perioadă | 4 straturi: K, L, M, N |
| A cincea perioadă | 5 straturi: K, L, M, N, O |
| A 6-a perioadă | 6 straturi: K, L, M, N, O, P |
| A 7-a perioadă | 7 straturi: K, L, M, N, O, P, Q |
Exemplu: element chimic localizat în a doua perioadă.
IV - GREȘIT. Elementele aparținând aceluiași grup au caracteristici similare și acest lucru se datorează faptului că au același număr de electroni în învelișul de valență.
Exemplu:
| Beriliu | Magneziu |
|
2 electroni în stratul de valență. |
2 electroni în stratul de valență. |
Prin urmare, beriliu și magneziu fac parte din grupa 2 din Tabelul periodic.
întrebarea 3
(Unitins) În ceea ce privește clasificarea periodică modernă a elementelor, identificați afirmația adevărată:
a) într-o familie, elementele au în general același număr de electroni în ultima coajă.
b) pe tabelul periodic, elementele chimice sunt plasate în ordine descrescătoare a masei atomice.
c) într-o familie, elementele au proprietăți chimice foarte diferite.
d) într-o perioadă, elementele au proprietăți chimice similare.
e) toate elementele reprezentative aparțin grupei B din tabelul periodic.
Alternativă corectă: a) într-o familie, elementele au în general același număr de electroni în ultima coajă.
a) CORECT. Elementele chimice din aceeași familie au același număr de electroni în ultima coajă și acest lucru le face să aibă caracteristici similare.
b) GRESIT. Masele atomice cresc pe măsură ce crește numărul atomic al elementului.
c) GRESIT. Proprietățile chimice ale elementelor sunt similare, deci sunt grupate în aceeași familie.
d) GRESIT. La un moment dat, elementele au electronii distribuiți în același număr de cochilii.
e) GRESIT. Elementele reprezentative aparțin grupei A, care corespunde familiilor: 1A, 2A, 3A, 4A, 5A, 6A, 7A și 8A. Elementele care aparțin grupului B sunt elemente de tranziție.
întrebarea 4
(Vunesp) Având în vedere proprietățile elementelor chimice și tabelul periodic, este incorect să se afirme:
a) un metal este o substanță care conduce curentul electric, este ductil și maleabil.
b) un nemetal este o substanță care nu conduce curent electric, nu este nici ductil, nici maleabil.
c) un semimetal are aspectul fizic al unui metal, dar comportament chimic similar cu cel al unui nemetal.
d) majoritatea elementelor chimice sunt formate din nemetale.
e) gazele nobile sunt monoatomice.
Alternativă incorectă: d) majoritatea elementelor chimice sunt nemetale.
Rețineți clasificarea elementelor chimice pe tabelul periodic în metale, nemetale și semimetale.

După cum putem vedea, majoritatea elementelor sunt metale.
a) CORECT. Metalele conduc electricitatea din cauza norilor de electroni formați din electroni liberi, care sunt caracteristici structurii lor. Sunt ductile, deoarece se pot transforma în fire sau foi, în funcție de regiunea în care se aplică presiune. De asemenea, sunt maleabile, deoarece cu acest tip de material se pot produce foi foarte subțiri.
b) CORECT. Nemetalele au caracteristicile opuse ale metalelor. În loc de conductori, aceștia sunt buni izolatori termici și, deoarece sunt fragili, nu sunt mulați în fire sau foi, deoarece nu au o ductilitate și maleabilitate bune.
c) CORECT. Semimetalele au caracteristici intermediare metalelor și nemetalelor. Fiind semiconductori ai electricității, au un luciu metalic, dar sunt fragili ca nemetalele.
d) GRESIT. Majoritatea elementelor sunt clasificate ca metale. Clasele de metale prezente în tabelul periodic sunt: alcaline, alcalino-pământoase, de tranziție interne și externe.
e) CORECT. Gazele nobile sunt monoatomice, deci sunt reprezentate doar de inițialele lor.
Exemplu:
| gaz nobil | calcogen |
| Heliu (El) | Oxigen (O2) |
| monoatomic: format dintr-un atom | diatomic: format din doi atomi |
Datorită stabilității gazelor nobile, elementele acestei familii au o reactivitate scăzută și sunt cunoscute și ca inerte.
întrebarea 5
Despre organizarea actualului tabel periodic, răspundeți:
a) Ce sunt coloanele?
b) Care sunt liniile?
c) Care este metoda utilizată pentru organizarea elementelor chimice?
Răspunsuri:
a) coloanele sunt grupurile Tabelului periodic, denumite anterior familii, care reunesc elemente chimice cu proprietăți similare.
b) Liniile sunt perioadele Tabelului periodic și indică numărul de straturi electronice ale unui atom în starea de bază.
c) Elementele chimice din tabelul periodic actual sunt aranjate în ordine crescătoare a numărului atomic, care indică numărul de protoni din nucleul atomului.
Familii de tabele periodice
intrebarea 1
(CESGRANRIO) Efectuând asocierea dintre coloanele de mai jos, care corespund familiilor de elemente conform tabelului periodic, secvența numerică va fi:
| 1. gaze nobile | • Grupa 1A |
| 2. Metale alcaline | • Grupa 2A |
| 3. metale alcalino-pământoase | • Grupa 6A |
| 4. Chalcogeni | • Grupul 7A |
| 5. Halogeni | • Grupa 0 |
a) 1, 2, 3, 4, 5.
b) 2, 3, 4, 5, 1.
c) 3, 2, 5, 4, 1.
d) 3, 2, 4, 5, 1.
e) 5, 2, 4, 3, 1.
Alternativă corectă: b) 2, 3, 4, 5, 1.
| grupuri | configurație electronică |
| • Grupa 1A: 2. Metale alcaline | ne1 (cu n |
| • Grupa 2A: 3. metale alcalino-pământoase | ne2 (cu n |
| • Grupa 6A: 4. Chalcogeni | ne2np4 |
| • Grupa 7A: 5. Halogeni | ne2np5 |
| • Grupa 0: 1. gaze nobile | 1s2 (El) sau noi2np6 (dacă n> 1) |
intrebarea 2
(UECE) Elementul chimic cu Z = 54 are în stratul său de valență configurația 5s2 5p6. Elementele cu Z = 52 și cu Z = 56 aparțin familiilor de:
a) calcogeni și alcalino-pământoși
b) halogeni și alcalii
c) halogeni și alcalino-pământoși
d) calcogeni și alcalii
Alternativă corectă: a) calcogeni și pământuri alcaline.
Având în vedere numerele atomice, am efectuat distribuția electronică și am găsit următoarele rezultate:
| 54X și | 52Tu | 56Ba |
|
8 electroni în stratul de valență |
6 electroni în stratul de valență |
2 electroni în stratul de valență |
| Nobile Gaze: 8A familie | Chalcogeni: 6A familie | Pământ alcalin: familia 2A |
întrebarea 3
(F. Ibero-Americana-SP) Grupul Tabelului Periodic care se caracterizează prin predominarea elementelor artificiale este următorul:
a) lantanide
b) gaze nobile
c) metale de tranziție
d) metale alcalino-pământoase
e) actinide
Alternativă corectă: e) actinide.
Elementele artificiale sunt cele care nu există în natură și care au fost sintetizate în laborator prin reacții nucleare.
Ele sunt, de asemenea, numite elemente transuranice, deoarece aceste elemente radioactive au un număr atomic mai mare de 92, care corespunde uraniului.
În general, aceste elemente sunt de scurtă durată, durând până la fracțiuni de secundă.
Conform acestor informații, trebuie să:
Elementele găsite în natură sunt: lantanide, gaze nobile, metale de tranziție și metale alcalino-pământoase. Cu excepția tehneciului și a prometiului, care sunt artificiale.
Predominanța elementelor artificiale este actinidele, clasificate ca metale de tranziție internă și inserate în tabelul periodic de sub lantanide. Din acea serie, numai actiniu, toriu, protactiniu și uraniu sunt naturale.
întrebarea 4
(U. Biserica Catolică din Salvador-BA) Specia X2- cu 8 electroni în învelișul exterior (învelișul de valență) poate fi din elementul X, care, în tabelul periodic, aparține grupului:
a) 7A
b) 6A
c) 2A
d) 1A
e) 8A
Alternativă corectă: b) 6A.
Conform regulii octetului, pentru ca un element să capete stabilitate, acesta își asumă configurația electronică a unui gaz nobil, care are 8 electroni în carcasa de valență.
Încărcați 2- pe speciile X2- indică faptul că elementul a câștigat 2 electroni.
Configurația electronică a speciei având 8 electroni în învelișul exterior este ns2np6.
După pierderea a doi electroni, elementul revine la starea sa de bază cu configurație ns electron2np4.
Cei 6 electroni din carcasa de valență sunt caracteristici pentru calcogeni, elemente din familia 6A.
De exemplu:
| Element: oxigen | configurație electronică |
| 8O | 1s22s22p4 |
| specia O2- | 1s22s22p6 |
Află mai multe despre Familii de tabele periodice.
Elemente chimice
intrebarea 1
(CESGRANRIO) Având în vedere elementele numerelor atomice 3, 9, 11, 12, 20, 37, 38, 47, 55, 56 și 75, opțiunea care conține doar metale alcaline este:
a) 3, 11, 37 și 55
b) 3, 9, 37 și 55
c) 9, 11, 38 și 55
d) 12, 20, 38 și 56
e) 12, 37, 47 și 75
Alternativă corectă: a) 3, 11, 37 și 55
Metalele alcaline corespund elementelor chimice care termină distribuția electronică cu un electron din subnivelul.
Efectuând distribuția electronică a numerelor atomice date, avem următoarele metale alcaline:
| Z = 3 | Z = 11 | Z = 37 | Z = 55 |
| Litiu | Sodiu | Rubidiu | Cesiu |
Celelalte numere atomice corespund elementelor din următoarele grupuri:
Metale alcalino-pământoase: încetează distribuția electronică la subnivel2.
| Z = 12 | Z = 38 | Z = 56 |
| Magneziu | Stronţiu | Bariu |
Metale de tranziție: terminați distribuția electronică la subnivelul d.
| Z = 30 | Z = 47 | Z = 75 |
| Zinc | Argint | Reniu |
Halogeni: terminați distribuția electronică la subnivelul p5.
| Z = 9 |
intrebarea 2
(Unirio) „Inima artificială plasată în Eloi a început să fie dezvoltată acum patru ani în Statele Unite și este deja folosită de aproximativ 500 de persoane. Setul, numit Heartmate, este alcătuit din trei piese principale. Cea mai importantă este o geantă rotundă de patru kilograme, cu diametrul de 12 centimetri și grosimea de 3 centimetri, din titan - un metal alb-argintiu, ușor și puternic. ” Revista Veja, iulie 1999.
Dintre metalele de mai jos, cel care are, în ultimul strat, un număr de electroni egal cu cel al titanului este:
a) C
cos
c) Ga
d) Mg
exe
Alternativă corectă: d) Mg.
| Titan | configurație electronică | Distribuția stratului |
| 22Tu | 1s2 2s2 2p6 3s2 3p6 4s2 3d2 | 2, 8, 10, 2 |
Din distribuția electronică a titanului, vedem că acest element are 2 electroni în ultima carcasă.
| Element | configurație electronică | Distribuția stratului |
| 6Ç | 1s2 2s2 2p2 | 2, 4 |
| 11La | 1s2 2s2 2p6 3s1 | 2, 8, 1 |
| 31Ga | 1s2 2s2 2p6 3s2 3p6 4s2 3d104p1 | 2, 8, 18, 3 |
| 12mg | 1s2 2s2 2p6 3s2 | 2, 8, 2 |
| 54X și | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 | 2, 8, 18, 18, 8 |
Elementul care are și 2 electroni în ultima coajă este magneziul.
întrebarea 3
(UFPA) Luați în considerare un anumit element chimic al cărui subnivel cel mai energetic este 5s2. Numărul său atomic și grupul în care este situat pe tabelul periodic sunt, respectiv:
a) 20; 1A
b) 20; 2A
c) 38; 2A
d) 38; 1A
e) 39; 2A
Alternativă corectă: c) 38; 2A
Prin distribuirea electronică, am constatat că:
- Elementul chimic este situat în familie 2A, deoarece are cel mai energic subnivel s2
- Are număr atomic 38, care corespunde numărului total de electroni distribuiți.
- Este localizat în a cincea perioadă, deoarece distribuția electronică a fost efectuată până la al cincilea strat.
Verificând aceste informații în Tabelul periodic, putem confirma că este elementul stronțiu.
întrebarea 4
(UFC) Un atom x are un proton mai mult decât un atom y. Pe baza acestor informații, determinați afirmația corectă.
a) Dacă y este alcalin pământos, x este metal alcalin.
b) Dacă y este un gaz nobil, x este un halogen.
c) Dacă y este un metal de tranziție, x este un gaz nobil.
d) Dacă y este un gaz nobil, x este un metal alcalin.
e) x este situat în aceeași perioadă înainte de atomul y din tabelul periodic.
Alternativă corectă: d) Dacă y este un gaz nobil, x este un metal alcalin.
Tabelul periodic este aranjat în ordine crescătoare a numărului atomic.
Dacă Y are număr atomic z și X are un proton mai mult decât acesta, înseamnă că aceste două elemente sunt în aceeași perioadă și X este ulterior lui Y.
Exemplu:
| Element | element ulterior |
| zDa | z + 1X |
| 11La | 12mg |
Cele două elemente sunt în a 3-a perioadă, iar magneziul are un proton mai mult decât sodiul.
Conform acestui raționament, trebuie să:
a) GRESIT. Un metal alcalin apare înaintea unui metal alcalin pământesc pe tabelul periodic. Afirmația corectă ar fi: Dacă y este metal alcalin, x este alcalin pământos.
b) GRESIT. Un halogen vine înaintea gazului nobil de pe tabelul periodic. Afirmația corectă ar fi: Dacă y este halogen, x este gaz nobil.
c) GRESIT. Metalele de tranziție și gazele nobile sunt separate de alte elemente chimice și, prin urmare, nu sunt secvențiale.
d) CORECT. Gazele nobile sunt ultimul grup de pe tabelul periodic, iar metalele alcaline sunt primele, deci sunt secvențiale.
Exemplu:
| gaz nobil | metal alcalin |
| zDa | z + 1X |
| 2el | 3citit |
Litiul, un metal alcalin, are un proton mai mult decât heliul, care este un gaz nobil.
e) GRESIT. X se află în aceeași perioadă ca Y numai după ea, nu înainte ca stările alternative.
întrebarea 5
Din numărul atomic al unui element chimic este posibil să se știe:
a) numărul de neutroni din nucleu
b) numărul de electroni din electrosferă
c) masa miezului
Răspuns: b) numărul de electroni din electrosferă
Un atom în stare de bază este neutru din punct de vedere electric. Deci, cunoscând numărul atomic, care corespunde numărului de protoni (particule încărcate pozitiv), știm numărul de electroni (particule încărcate negativ) din electrosferă.
De exemplu, fierul are un număr atomic 26, deci în stare de bază are 26 de electroni în jurul nucleului.
Află mai multe despre elemente chimice este numar atomic.
Proprietăți periodice și aperiodice
intrebarea 1
(UFSM) Judecați dacă afirmațiile legate de proprietățile periodice ale elementelor sunt adevărate (T) sau false (F).
() Depinde de masele atomice ale elementelor.
() Se repetă la intervale mai mult sau mai puțin regulate în raport cu creșterea numărului atomic.
() Sunt similare în același grup de elemente.
() Sunt similare în aceeași perioadă de elemente.
() În același grup, valorile numerice ale proprietăților periodice cresc întotdeauna atunci când există o creștere a numărului atomic de elemente.
Secvența corectă este:
a) V - F - V - F - F
b) V - F - F - V - V
c) F - V - V - F - F
d) F - V - F - V - V
e) V - F - F - V - F
Alternativă corectă: c) F - V - V - F - F
(FALS) Depinde de masele atomice ale elementelor.
Conform legii periodicității lui Moseley, multe proprietăți fizice și chimice ale elementelor chimice variază în funcție de numărul atomic.
(ADEVĂRAT) Se repetă la intervale mai mult sau mai puțin regulate în raport cu creșterea numărului atomic.
Proprietăți precum raza atomică, volumul atomic, densitatea, punctul de topire și fierberea sunt exemple de proprietăți care se repetă în mod regulat în tabelul periodic.
(ADEVĂRAT) Sunt similare în același grup de elemente.
Grupurile de tabele periodice au fost aranjate cu elemente care au proprietăți similare.
(FALS) Sunt similare în aceeași perioadă de elemente.
Proprietățile sunt similare în familii, nu în perioade. În perioade, elementele sunt distribuite după numărul de straturi electronice.
(FALS) În același grup, valorile numerice ale proprietăților periodice cresc întotdeauna atunci când există o creștere a numărului atomic de elemente.
Proprietățile pot crește sau scădea în funcție de numărul atomic. Un exemplu în acest sens este electronegativitatea, care scade pe măsură ce numărul atomic crește într-un grup dat.
Citește și: Proprietăți periodice
intrebarea 2
(FAESP) Proprietățile aperiodice ale elementelor sunt:
a) densitatea, volumul atomic și masa atomică.
b) punctul de topire, electronegativitatea și căldura specifică.
c) volumul atomic, masa atomică și punctul de topire.
d) masa atomică, căldura specifică și punctul de topire.
e) masa atomică și căldura specifică.
Alternativă corectă: e) masa atomică și căldura specifică.
Proprietățile aperiodice se repetă la intervale regulate.
Masa atomică este măsura greutății atomului în unități de masă atomică, care corespunde a masei carbon-12.
Căldura specifică determină cantitatea de căldură necesară pentru a crește temperatura cu 1 ° C de 1 g de element.
Aceste două proprietăți nu au legătură cu poziția elementului pe tabelul periodic.
Celelalte proprietăți sunt clasificate ca periodice pe măsură ce cresc sau scad cu numărul atomic. Sunt ei:
- Densitate: reprezintă coeficientul dintre masa și volumul unui element.
- Volumul atomic: reprezintă volumul unui set de atomi și influențează distanța dintre aceștia.
- Punct de topire: temperatura la care are loc tranziția de la solid la lichid.
- Electronegativitate: capacitatea atomului de a atrage la sine perechea electronică pe care o împarte într-o legătură covalentă.
Citește și: electronegativitate și Afinitate electronică
întrebarea 3
(PUC-PR) Dintre următoarele diagrame legate de tabelul periodic, care sunt corecte?
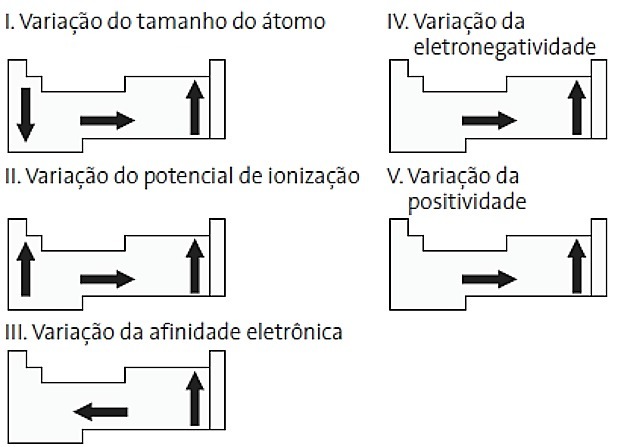
a) II și V
b) II și III
c) I și V
d) II și IV
e) III și IV
Alternativă corectă: d) II și IV.
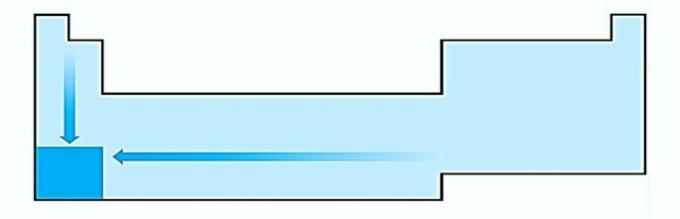
I. GRESIT. Variația mărimii atomului este măsurată de distanța medie de la nucleu la electronul cel mai exterior. Cei mai mari atomi sunt situați în partea de jos a tabelului, astfel încât creșterea are loc în funcție de numărul atomic și reprezentarea corectă este:
II. CORECT Energia necesară pentru a smulge un electron de pe un atom izolat în stare gazoasă se numește potențial de ionizare. Crește așa cum se arată în diagrama de declarații.
III. GRESIT. Afinitatea electronică exprimă energia eliberată atunci când un atom neutru în stare gazoasă primește un electron, care este o proprietate foarte importantă a nemetalelor. Cele mai mari afinități electronice sunt observate la halogeni și oxigen.
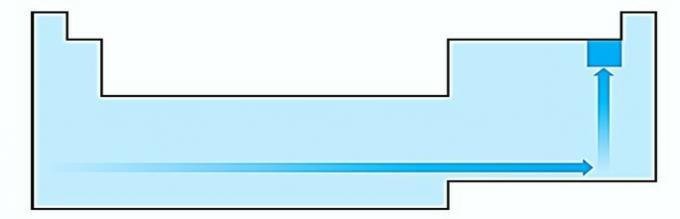
IV. CORECT Electronegativitatea este legată de potențialul de ionizare și afinitatea electronică. Ca atare, halogenii sunt elementele cele mai electronegative din tabelul periodic.
V. GRESIT. Electropozitivitatea apare în direcția opusă electronegativității. Reprezintă capacitatea atomului de a renunța la electroni.
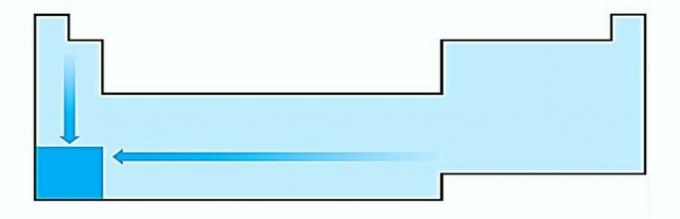
Prin urmare, metalele alcaline au cea mai mare electropozitivitate.
Continuați să vă testați cunoștințele cu listele:
- Exerciții de legături chimice
- Exerciții de distribuție electronică
- Exerciții pe modele atomice
- Exerciții de termochimie

